溶液酸度对沉淀溶解度的影响称为酸效应(acid effect)。酸效应的影响比较复杂,这里主要考虑酸度对弱酸盐溶解度的影响。
很多难溶化合物是弱酸或弱碱所生成的盐,其溶解度受溶液的影响很大。例如对于沉淀MA,在不同的酸度下会发生下列副反应:
增大溶液的酸度,可能使A与H+结合生成相应的酸;反之,降低酸度,可能使M发生水解,即生成金属羟基配合物,这都将使平衡向沉淀溶解的方向移动,导致沉淀溶解度增大。
当溶液的pH已知时,就可计算出酸效应系数α{A(H)},再根据式(6.10)得到条件溶度积![]() ,进而计算出溶解度。此外,在分析工作中还经常要计算在过量沉淀剂存在下,弱酸盐在某酸度时的溶解度,借以判断沉淀是否完全。现举例说明。
,进而计算出溶解度。此外,在分析工作中还经常要计算在过量沉淀剂存在下,弱酸盐在某酸度时的溶解度,借以判断沉淀是否完全。现举例说明。
例6.7 计算CaC2O4分别在下列情况下的溶解度:(1)在pH=1.00时,(2)在pH=4.00,溶液中未沉淀的草酸总浓度为0.10 mol·L-1时。已知K sp(CaC2O4)=10-8.63,p K a1=p K a(H2C2O4)=1.25,![]() (https://www.xing528.com)
(https://www.xing528.com)
解:(1)在pH=1.00时
在纯水中,s(CaC2O4)=10-8.63/2 mol·L-1=4.8×10-5 mol·L-1,故在pH=1.00时,酸效应使CaC2O4的溶解度增加。
(2)这是同时存在酸效应和同离子效应的情况,此时pH=4.00,c(H2C2O4)=0.10 mol·L-1
沉淀剂过量,s=s(CaC2O4)=[Ca2+],![]() =0.10+s≈0.10 mol·L-1,[Ca2+]=
=0.10+s≈0.10 mol·L-1,[Ca2+]=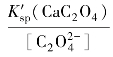 =10-7.17 mol·L-1=6.8×10-8 mol·L-1。可见,在此条件下,Ca2+沉淀是完全的。
=10-7.17 mol·L-1=6.8×10-8 mol·L-1。可见,在此条件下,Ca2+沉淀是完全的。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




