物质在水中的溶解作用是一个较复杂的物理-化学过程。溶解度的大小受多种因素的影响,如晶格能、水合焓、熵变以及溶解温度、外加可溶性盐、酸度、配位剂等均对溶解度有影响。各种不同的物质在水中的溶解度不同,有些表面上看来不溶的物质实际上也不是绝对不溶。绝对不溶的物质是没有的,通常把溶解度小于0.01 g/(100 g H2O)的物质叫作不溶物,严格说来,应叫难溶物或微溶物(slightly soluble substance)。上述界限也不是绝对的。例如PbCl2(s)的溶解度常温下为0.675 g/(100 g H2O),远大于上述标准。但由于PbCl2的摩尔质量较大,其饱和时的浓度(用物质的量浓度表示)很小,故此类物质也属于本章讨论的内容。PbCl2(s)、AgCl(s)、CaCO3(s)等类物质虽然溶解度很小,但溶解的部分都是完全电离的,溶液中不存在未电离的分子,故也常称为难溶强电解质或简称其为难溶盐。
一定温度下,把难溶强电解质例如CaCO3放在水中时,水分子以其偶极的负端,取向在CaCO3固体表面的Ca2+周围,而有些水分子则以偶极的正端,取向在CaCO3固体表面的![]() 周围。由于水分子具有较高的介电常数,水分子的这种取向作用大大地减弱了固态中
周围。由于水分子具有较高的介电常数,水分子的这种取向作用大大地减弱了固态中![]() 和
和![]() 之间的吸引力,而使得一部分Ca2+和
之间的吸引力,而使得一部分Ca2+和![]() 离开CaCO3固体表面,成为水合离子进入溶液,这个过程称为溶解(dissolution)。另外,溶液中水合的Ca2+和
离开CaCO3固体表面,成为水合离子进入溶液,这个过程称为溶解(dissolution)。另外,溶液中水合的Ca2+和![]() 处在无序的运动中,其中有些碰撞到固体CaCO3表面时,受到固体表面的吸引力,又会重新析出或回到固体表面上来,这个过程称为沉淀(precipitation)。图6-1所示为沉淀形成过程。
处在无序的运动中,其中有些碰撞到固体CaCO3表面时,受到固体表面的吸引力,又会重新析出或回到固体表面上来,这个过程称为沉淀(precipitation)。图6-1所示为沉淀形成过程。
溶解和沉淀这两个过程是相互矛盾的过程。初期,由于溶液中水合Ca2+和![]() 浓度极小,CaCO3的溶解速度较大,这时溶液是未饱和的;随着溶解作用的继续进行,水合Ca2+和
浓度极小,CaCO3的溶解速度较大,这时溶液是未饱和的;随着溶解作用的继续进行,水合Ca2+和![]() 浓度逐渐加大,相互碰撞再返回固体CaCO3表面的机会增多,即沉淀速度增大;当溶解的速度和沉淀速度相等,便达到了动态平衡,这时的溶液是饱和溶液(saturate solution)。此时溶液中的离子浓度(严格讲,应是活度)不再改变,未溶解的固体CaCO3与溶液中的Ca2+和
浓度逐渐加大,相互碰撞再返回固体CaCO3表面的机会增多,即沉淀速度增大;当溶解的速度和沉淀速度相等,便达到了动态平衡,这时的溶液是饱和溶液(saturate solution)。此时溶液中的离子浓度(严格讲,应是活度)不再改变,未溶解的固体CaCO3与溶液中的Ca2+和![]() 之间存在着下列平衡:
之间存在着下列平衡:
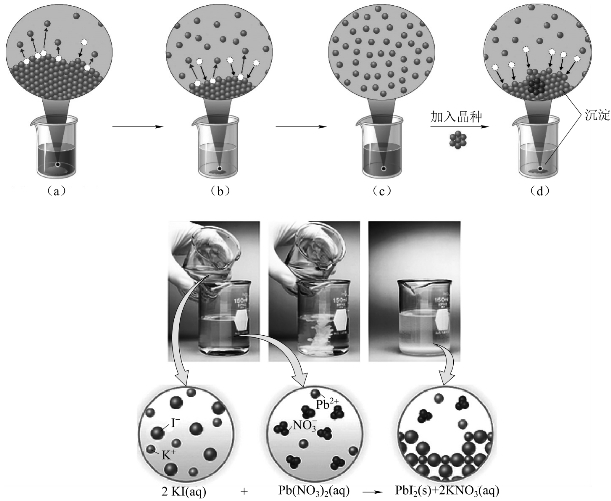
图6-1 沉淀生成
(a)不饱和溶液;(b)饱和溶液;(c)过饱和溶液;(d)形成沉淀
![]()
按照化学平衡定律,则有
![]()
 称为活度积(activity product),在定温下有定值,它实际上是上述平衡式的平衡常数。
称为活度积(activity product),在定温下有定值,它实际上是上述平衡式的平衡常数。
对任何沉淀-溶解达到平衡的系统,可表示为
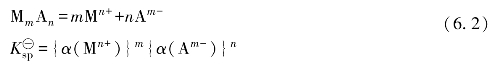
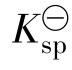 的值可根据如下的热力学公式进行计算:
的值可根据如下的热力学公式进行计算:
![]()
根据热力学公式:
![]()
式中,Qi是未达平衡时的离子积。
当在饱和的CaCO3溶液中加入Na2CO3,![]() 的浓度增加时,
的浓度增加时,![]() 时,ΔG>0,此时反应将向左进行,即发生CaCO3的沉淀反应。
时,ΔG>0,此时反应将向左进行,即发生CaCO3的沉淀反应。
当![]() 时,例如在饱和的CaCO3溶液中加入盐酸,由于
时,例如在饱和的CaCO3溶液中加入盐酸,由于![]() 的浓度减少,导致Qi<
的浓度减少,导致Qi<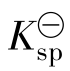 ,ΔG<0,此时反应将向右进行,即发生CaCO3的继续溶解反应。图6-2所示为Cr(OH)3溶度积曲线。
,ΔG<0,此时反应将向右进行,即发生CaCO3的继续溶解反应。图6-2所示为Cr(OH)3溶度积曲线。

图6-2 溶度积曲线
A—沉淀溶解;B—沉淀和溶液达到平衡;C—沉淀析出
例6.1 如果在40 mL 0.01 mol·L-1 MgCl2溶液中,加入10 mL 0.01 mol·L-1NaOH溶液,问有无沉淀产生?
已知![]() (https://www.xing528.com)
(https://www.xing528.com)
解:两种溶液混合后,总体积为50 mL,则

因而有Mg(OH)2沉淀产生。
例6.2 已知![]() =1.17×10-5,若将5.0 g Pb(NO3)2加到1 L 0.01 mol·L-1 NaCl溶液中,问有无沉淀产生?
=1.17×10-5,若将5.0 g Pb(NO3)2加到1 L 0.01 mol·L-1 NaCl溶液中,问有无沉淀产生?
已知M{Pb(NO3)2}=331.2 g·mol-1。
解:若忽略因固体Pb(NO3)2的加入而带来的体积变化,则溶液中Pb2+的浓度为

所以没有PbCl2沉淀生成,这是一个不饱和溶液。
例6.3 已知室温下,![]() =2.26×10-48,求Cu2S的溶解度。
=2.26×10-48,求Cu2S的溶解度。
解:忽略S2-的水解作用,Cu2S按照下列方程式溶于水而形成饱和溶液:
![]()
设Cu2S在水中的溶解度为s(mol·L-1),则饱和溶液中的[Cu+]=2s,[S2-]=s。

例6.4 已知25℃时,![]() =1.77×10-10,
=1.77×10-10,![]() =5.40×10-12。试通过计算说明哪一种盐在水中溶解度较大。
=5.40×10-12。试通过计算说明哪一种盐在水中溶解度较大。
解:在AgCl的饱和溶液中,存在如下平衡:
![]()
设AgCl在水中的溶解度为s1(mol·L-1),则平衡时

同理,在Ag2CrO4饱和溶液中
![]()
设Ag2CrO4在水中的溶解度为s2,则平衡时
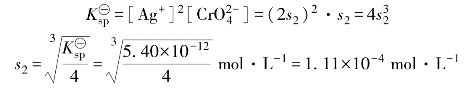
计算表明s2>s1,因而Ag2CrO4在水中的溶解度比AgCl的要大。
以上几个例题表明,溶度积常数![]() 可用来估计和比较难溶强电解质溶解度的大小。相同类型的难溶电解质(例如同是1-1型或1-2型)相互比较时,
可用来估计和比较难溶强电解质溶解度的大小。相同类型的难溶电解质(例如同是1-1型或1-2型)相互比较时,![]() 值越小,其溶解度也越小。但是不同类型的难溶电解质则不能做这样的比较。如在例6.4中,虽然
值越小,其溶解度也越小。但是不同类型的难溶电解质则不能做这样的比较。如在例6.4中,虽然![]() <
<![]() ,但Ag2CrO4的溶解度却比AgCl的要大。
,但Ag2CrO4的溶解度却比AgCl的要大。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




