就EDTA而言,它存在逐级平衡,每一步都有H+参加。如果改变溶液的pH,就会影响平衡,改变配体各物种的浓度。因此,酸效应会引起许多副反应。
1.配位剂Y的酸效应系数
配位剂L是一种碱,易接受质子,因此,配位剂Y与H的副反应是相当严重的。当它与M进行配位时,游离配位剂的浓度[Y]将受溶液酸度的影响。这种由于H使配位剂参加配位反应的能力降低的现象称为酸效应,它是一种副反应。酸效应系数:

式(5.9)表明,对于配位剂Y来说,酸效应系数α{Y(H)}仅是[H]的函数,而与配位剂的浓度无关。根据累积质子化常数![]() 的值即可计算出在给定酸度下的α{Y(H)}值。
的值即可计算出在给定酸度下的α{Y(H)}值。
例5.2 计算在pH=5([H+]=10-5 mol·L-1)时EDTA的酸效应系数。
解:根据式(5.9),并根据表5-1,EDTA的累积质子化常数![]() 的值为
的值为

在类似的计算中,虽然涉及的项较多,但在给定条件下只有少数几项是主要的,通常比最大项小二次方以上的项均可忽略。由于数值较大,涉及的指数差别也很大,故常用指数或对数形式表示。α{Y(H)}的值很重要,为应用方便,将不同pH下EDTA的lg α{Y(H)}列成表格,见表5-4。
表5-4 不同pH下EDTA的lg α{Y(H)}

酸效应对配合物的稳定性有很大的影响。考虑到EDTA在溶液中实际上有各种形式,各种物种(HY,H 2 Y,…)的量取决于H+的浓度。配体的总浓度应考虑酸效应系数lg α{Y(H)}(或缩写为α(Y))的校正。即
![]()
在只考虑酸效应时,条件稳定常数为

式中的Y′用上式代入得

上式也可以写成
![]()
设被测离子浓度为c(M),若允许滴定的终点误差为±0.1%,在滴定至终点时

代入式(5.10)得
![]()
即
![]()
对于浓度为0.01 mol·L-1的金属离子溶液,能用EDTA准确滴定的条件应是(https://www.xing528.com)
![]()
为了确定滴定金属离子时的最大酸度(即所允许的最低pH),可将式(5.10a)写成
![]()
如被测离子浓度为c(M)=0.01 mol·L-1,将式(5.10c)代入得
![]()
式(5.10e)就是计算滴定0.01 mol·L-1金属离子溶液所允许的最低pH。
2.金属离子M的副反应系数α(M)
若金属离子M与其他配位剂A(或OH-)发生副反应,则副反应系数:

不难证明
![]()
式中,β1~βn为M和A所形成的配合物的各级累积稳定常数。
这里的A可能是滴定所需的缓冲剂或辅助配位剂,也可能是为消除干扰而加入的掩蔽剂,故α{M(A)}又称金属离子的辅助配位效应系数。如在氨性溶液中滴定Zn2+、Cu2+、Cd2+等,氨既是缓冲剂,又是辅助配位剂,可防止Zn2+等在较高pH下产生沉淀,此外,M还可能水解而形成羟基配合物M(OH),M(OH)2,…。其副反应系数称为金属离子的水解效应系数:
![]()
例5.3 计算pH=10时的lg α{Pb(OH)}值。
解:Pb2+-OH-配合物的lg β1-lg β3分别为6.2、10.3和13.3,代入式(5.12)得

实际情况往往是金属离子同时发生多种副反应。若M既与A又与OH-发生副反应,这时金属离子总的副反应系数为

在同时考虑酸效应和金属离子的副反应时,条件稳定常数为
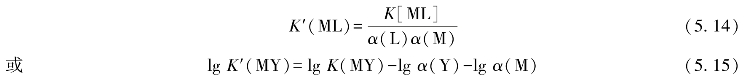
在进一步考虑配合物[MY]的副反应时,则应再加上[MY]的副反应系数α(MY)

由于配合物的副反应有利于配合反应向右进行,故式(5.17)中配合物的副反应系数的对数项lg α(MY)为加号。
总之,EDTA能与许多金属离子生成稳定的配合物。配合物的条件稳定常数K′(MY)比稳定常数K(MY)能更加切合实际地反映出配合反应进行的程度。因此,了解和掌握条件稳定常数的计算是必要的。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




