两性物质在溶液中,既能给出质子,又能接受质子。酸式盐、弱酸弱碱盐和氨基酸等都是两性物质。较重要的两性物质如多元酸的酸式盐(如NaHCO3、NaH2PO4、Na2HPO4等)和弱酸弱碱盐(如NH4 Ac、NH4 CN等)以及氨基酸等。图4-5所示为典型的两性物质Cr(OH)3溶液。两性物质溶液的酸碱平衡比较复杂,需要根据具体情况针对溶液中的主要平衡进行处理。

图4-5 两性物质Cr(OH)3
现以NaHA溶液为例进行讨论,设NaHA浓度为c,可选HA-和H2O作参考水准,列出质子平衡式:
![]()
利用二元酸的平衡关系式可得

经整理得
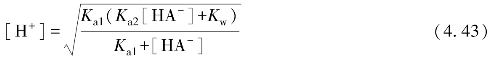
式(4.43)即为计算两性物质溶液[H+]的精确式。一般情况下,HA-的酸式解离和碱式解离的倾向都很小,因此,溶液中HA-的消耗很少。所以[HA-]≈c,代入式(4.43),得到计算酸式盐HA-溶液[H+]的近似式:

若K a2c≥20K w,式(4.44)可进一步简化为

又若c≥20K a1时,式(4.45)可简化为最简式:
![]()
例4.14 计算0.05 mol·L-1 NaHCO3溶液的pH。(https://www.xing528.com)
解:已知K a1=4.4×10-7,K a2=4.7×10-11,![]() =0.05 mol·L-1。因K a2 c>20K w,c>20K a1,故可采用最简式(4.46)计算:
=0.05 mol·L-1。因K a2 c>20K w,c>20K a1,故可采用最简式(4.46)计算:
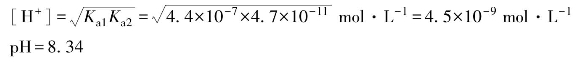
例4.15 计算0.033 mol·L-1 Na2HPO4溶液的pH。
解:![]() 涉及的解离常数是K a2=6.3×10-8和K a3=4.5×10-13,因此,K a3 c=4.5×10-13×0.033=1.5×10-14≈K w,故K w不能忽略。K a+c≈c,可用近似式(4.44)计算:
涉及的解离常数是K a2=6.3×10-8和K a3=4.5×10-13,因此,K a3 c=4.5×10-13×0.033=1.5×10-14≈K w,故K w不能忽略。K a+c≈c,可用近似式(4.44)计算:

若用最简式(4.46)计算,即忽略水的解离时, [H+] =1.7×10-10 mol·L-1,相对误差达23%。
氨基酸是另一种类型的两性物质。例如氨基乙酸在溶液中是以双极离子H3 NCH2 COO-存在的,它既能失去质子起酸的作用,又能得到质子起碱的作用:
![]()
对于氨基乙酸,一般手册及本书附表所列的p K a1(2.350)对应于![]() 的解离,p K a2(9.778)对应于
的解离,p K a2(9.778)对应于![]() 的解离。可见氨基乙酸的酸性(p K a2=9.778)和碱性(p K b2=p K w-p K a1=14.00-2.350=11.650)均很弱。
的解离。可见氨基乙酸的酸性(p K a2=9.778)和碱性(p K b2=p K w-p K a1=14.00-2.350=11.650)均很弱。
例4.16 计算0.10 mol·L-1氨基乙酸溶液的pH。
解:已知K a1=4.5×10-3,K a2=1.7×10-10,c(C2 H5 O2 N)=0.10 mol·L-1。因K a2>20K w,c>20K a1,故可用最简式(4.46)计算:
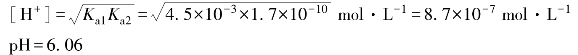
弱酸弱碱盐也是一种两性物质,也可以用同样的公式计算。
例4.17 计算0.10 mol·L-1 NH4Ac溶液的pH。
解:Ac-的共轭酸HAc的K a1=K a(HAc)=1.75×10-5,![]() 的K a2=
的K a2=![]() =5.70×10-10,c(NH4Ac)=0.10 mol·L-1。因c>20K a1,K a2c>20K w,故可用最简式(4.46)计算:
=5.70×10-10,c(NH4Ac)=0.10 mol·L-1。因c>20K a1,K a2c>20K w,故可用最简式(4.46)计算:
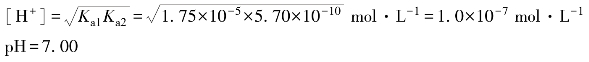
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




