酸碱质子理论虽然比酸碱离子论和溶剂论应用范围广,但它仍有局限性,其不能讨论不含质子的物质,也不适用于无质子传递的反应。例如,我们早已熟悉的反应:
![]()
虽然反应物都没有质子,但它们溶于水分别变成Ca(OH)2和H2SO4,而Ca(OH)2和H2SO4反应的结果却与CaO和SO3的反应一样,所以上述反应实质上也是酸碱反应。1923年,路易斯(G.N.Lewis)根据大量酸碱反应的化学键变化,从原子的电子结构观点概括了酸碱反应的共同性质,提出了著名的路易斯酸碱定义:在反应过程中,能接受电子对的任何分子、原子团或离子称为酸;能给出电子对的任何分子、原子团或离子称为碱(这样定义的酸碱,有时也称为路易斯酸和路易斯碱)。在酸碱反应过程中电子发生转移,碱性物质提供电子对,酸性物质接受电子对,形成配位共价键,其生成物则称为酸碱加合物。因而路易斯的理论又称为酸碱电子论。如图4-4所示。
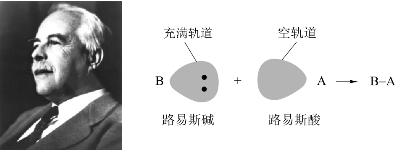
图4-4 路易斯酸碱理论
按照酸碱电子论的观点,一种酸和一种碱反应可生成酸碱加合物,用公式表示就是

例如:

在反应中,H2O分子与NH3分子都能提供一对电子给予质子,所以它们是路易斯碱。就质子论而言,H2O、NH3分子能与H+结合,它们也是碱,这两种理论的结论相同,不谋而合。但是就酸的概念来说,路易斯将酸的概念扩大了,因为能接受电子对的物质不仅仅是质子,也可以是金属离子或缺电子的分子(如表4-5中反应序列8)等。
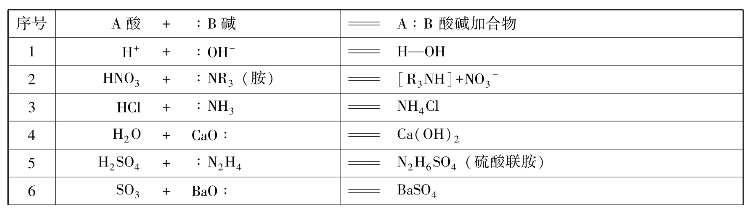
表4-5 酸碱加合反应
续表(https://www.xing528.com)
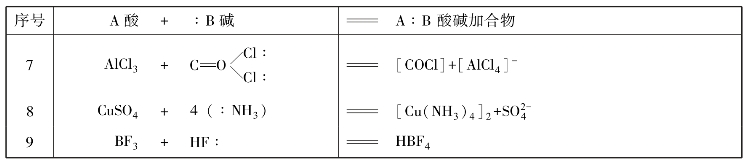
若酸碱加合物中键合原子共享由碱提供的电子对形成新的化学键,这种化学键属于配位键。例如:
![]()
CaO中的O有4对电子,能提供一对电子给SO3中的S形成酸碱加合物。所以CaO是碱,SO3是酸。表4-5列举了一些酸碱加合反应,凡是有质子传递的反应都可以用电子论的观点来解释。表中前5个反应都是与质子有关的加合反应。尽管表示法与质子论有所不同,但实质上是一致的。
表4-6中,有些酸或碱本身就是酸碱的加合物。它们却分别以酸或碱的身份进行加合反应,生成更复杂的加合物。例如,H2O在表中的第1个反应中是酸碱加合物,但在第4个反应中它又以酸的身份参加一些加合反应。由于加合反应比较复杂,因而酸的强弱常不能用一种简单的标度来量度。例如,NH3可作为碱,与Cu2+和Cd2+分别发生加合反应:
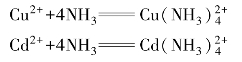
前一反应比较完全,平衡常数较大,表示Cu2+的酸性比Cd2+的强,但用CN-作为碱分别与Cu2+和Cd2+发生下列加合反应时:

后一反应比较完全,说明Cd2+的酸性反应比Cu2+的强,两者结论相反。所以,对于路易斯理论中的加合反应,不容易用简单的标度来衡量物质的酸碱性。
路易斯酸碱概念的使用范围较为广泛。一般来说,大多数配位化合物中含有金属离子,它可以接受电子,所以是酸;在金属离子周围的配位体可以提供电子对,所以是碱。在有机化合物中也可以解析为酸和碱两个部分,如乙酸乙酯(CH3COC2H5),可以解析为乙酰正离子和乙氧负离子。这种对有机化合物的解析方法在有机化学中已被广泛使用,作为推测有机化学反应的一种方法。由于其应用范围较广,故有人称其为广义的酸碱理论。
客观事物总有其二重性,电子论也不是完美无缺,其不足之处,主要表现在路易斯酸碱的强度没有统一的标准,缺乏像质子论那样明确的定量关系。一种物质究竟是酸或是碱,需从具体的反应中方能确定。因此,在处理水溶液体系中的酸碱问题,或在基础课的教学中,常采用质子理论或阿仑尼乌斯的理论。
关于酸碱理论的讨论,除了上述几种理论外,还有许多理论,如皮尔逊(Person)提出的软硬酸碱的概念等,人们对酸碱的认识,总是在不断地深入之中。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




