酸碱质子理论(proton theory of acid-base)是1923年分别由丹麦物理化学家布朗斯特(J.N.Bronsted)和英国化学家劳里(T.M.Lowry)同时提出的,又称为布朗斯特-劳里质子理论。如图4-2所示。酸碱质子理论认为:凡能够提供质子(proton)(氢离子hydrogen ion)的任何分子或离子就是酸(acid),凡能够与质子化合(或接受质子)的分子或离子就是碱(base)。
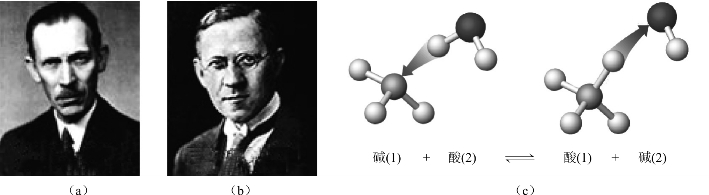
图4-2 布朗斯特-劳里酸碱质子理论
(a)布朗斯特;(b)劳里;(c)酸碱质子理论
酸和碱的关系可用下式表示:
 (https://www.xing528.com)
(https://www.xing528.com)
酸给出质子后,剩余的部分就是碱。在这类反应中,酸被看成是质子给予体(proton doner),碱为质子接受体(proton aceptor)。例如:

左边的反应物都是酸,它可以是分子、正离子或负离子;右边的产物有碱和H+,碱也可以是分子、正离子或负离子。一种酸与其释放一个质子后产生的碱称为共轭酸碱对(conjugated pair of acid-base),或者说一个碱与质子结合后而形成的酸共轭。由于酸解离出质子就变成它的共轭碱,所以酸比它的共轭碱永远多带一个正电荷。共轭的酸和碱必定同时存在。酸给出质子的倾向越强,则其共轭碱接受质子的倾向越弱;碱接受质子的倾向越强,则其共轭酸给出质子的倾向越弱。式(4.4)的后两例表明,![]() 在某一共轭酸碱对中是酸,在另一共轭酸碱对中是碱,这类分子或离子称为两性物质(amphoteric compound)。
在某一共轭酸碱对中是酸,在另一共轭酸碱对中是碱,这类分子或离子称为两性物质(amphoteric compound)。
水-离子理论把溶剂限制于水,而质子论不受溶剂的限制,它强调的是有质子参加反应的物质。因此,质子论的酸碱范围就广泛得多。水-离子理论把物质分为酸、碱和盐,而质子论把物质分为酸、碱和非酸非碱物质,例如水-离子理论认为Na2CO3是盐,质子论则认为![]() 是碱,而Na+是非酸非碱物质,它既不提供质子,也不接受质子。表4-2列举了常见的一些质子酸碱。
是碱,而Na+是非酸非碱物质,它既不提供质子,也不接受质子。表4-2列举了常见的一些质子酸碱。
表4-2 常见的质子酸碱

免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




