在水溶液中或熔融状态下能导电的物质称为电解质,不能导电的物质称为非电解质。根据其水溶液中导电能力的强弱,可分为强电解质(strong electrolyte)和弱电解质(weak electrolyte)。酸、碱、盐等无机化合物都是强电解质,其中强酸、强碱和典型的盐都是强电解质,弱酸、弱碱和某些盐(如氯化汞)是弱电解质。有机化合物中的乙酸、酚和胺等都是弱电解质。
从表4-1中的i值可以看出,在电解质溶液中的粒子数显然要多于同浓度的非电解质溶液。
表4-1 不同浓度下HCl、KCl、K 2SO4的i值i=各种依数性的实验值/依数性的理论值

1887年,阿仑尼乌斯(S.A.Arrhenius)(图4-1(a))根据电解质水溶液能导电和它的稀溶液的依数性“异常”的现象,认为电解质在水溶液中能部分电离成带有电荷的正、负离子,溶液中粒子的数目增加,所以i值总是大于1。对于KCl来说,如果它百分之百地电离,则粒子数增加一倍,i值应等于2,对于K2SO4而言,则i值应等于3,但由于电离的程度不同,而i值总是小于百分之百电离时质点数所增加的倍数(2,3,4,…)。阿仑尼乌斯认为在水溶液中电解质是部分电离的,在离子和未电离的分子之间建立了平衡,同时,他提出了电离度(degree of ionization)的概念,认为溶液越稀,电离度越大。所谓电离度(α),是指达到电离平衡时,总分子数中电离成离子的分数(或已电离的溶质分子数与原有溶质分子总数之比),用公式表示为
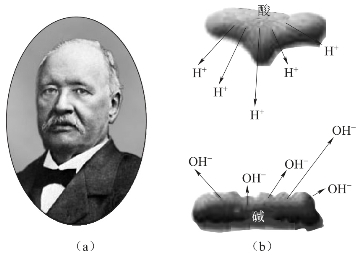
图4-1 阿仑尼乌斯(a)及其酸碱理论(b)(https://www.xing528.com)
![]()
![]()
例如HAc,设原始浓度为c,则平衡时:

这就是阿仑尼乌斯的部分电离学说。阿仑尼乌斯的理论对研究电解质溶液的性质做出了巨大的贡献。特别是对弱电解质,至今仍被普遍使用。但是随着科学的发展,发现这一理论存在着不少缺陷,如把所有电解质都看成是部分电离的,这一假定不符合事实。经X射线研究表明,在离子型化合物如固态NaCl中,根本没有NaCl分子存在。既然固态中不存在NaCl分子,而假定在溶液中出现NaCl分子,并和其离子建立平衡的假定是不合理的。对于溶液中的离子,它们带有不同的电荷,离子之间如何相互作用,这一点也是电离理论所没有考虑到的,特别是对强电解质,这个理论就不适用。
由部分电离理论可知,阿仑尼乌斯对于酸碱的定义为:酸在水溶液中解离出氢离子,而碱则解离出氢氧根离子。他因此而获得了1903年诺贝尔化学奖。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




