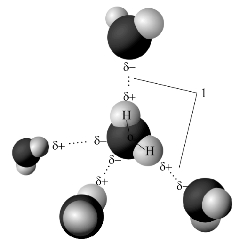
图3-42 水分子间的氢键
当氢原子与电负性较大、半径较小的原子X(如F、O、N)形成强极性共价键时,几乎裸露的质子对附近另一个分子中电负性较大、半径较小、有孤电子对且带有部分负电荷的原子Y(如F、O、N)产生较强的静电吸引,这种吸引作用力就是氢键(hydrogen bond)。
氢键通常用X—H…Y表示。X、Y可以是同种元素的原子,也可以是两种不同元素的原子。如NH3分子和H2O分子之间就可形成N—H…O或O—H…N形式的氢键,如图3-42所示。
在X—H…Y中,X、Y的电负性越大,形成的氢键就越强;当X相同时,Y的半径越小,越容易接近X—H,形成的氢键也越强,因此有如下氢键强弱顺序存在:
F—H…F>O—H…O>O—H…N>N—H…O>N—H…N
氢键具有饱和性和方向性。
氢键的饱和性指H原子在形成一个共价键后,只能再形成一个氢键,不能再与其他电负性大的原子形成第二个氢键。
氢键的方向性指在氢键中,以H原子为中心的3个原子尽量处在一条直线上,以使两个电负性大的原子相距最远,排斥力最小,形成的氢键强度最大,系统的能量最低。
氢键的键能比化学键弱得多,与范德华力大小相当。氢键的本质是静电引力。
氢键可在分子与分子之间形成,即分子间氢键(intermolecular hydrogen bond),如图3-43所示。
氢键使分子间的结合力增强。要使这些物质熔化、汽化,就必须附加额外的能量去破坏分子间的氢键。因此,分子间氢键的形成,可使物质的熔、沸点升高。
氢键也可在分子内形成,即分子内氢键(intramolecular hydrogen bond),如图3-44所示。(https://www.xing528.com)
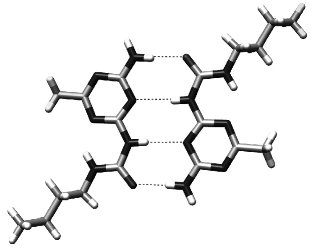
图3-43 分子间氢键
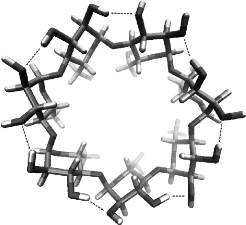
图3-44 分子内氢键
分子内形成的氢键X—H…Y,3个原子往往不在一条直线上,不稳定,易断开,通常会使物质的熔、沸点降低。图3-45表示氢键的生成对氢化物沸点的影响,熔点变化规律亦相同。
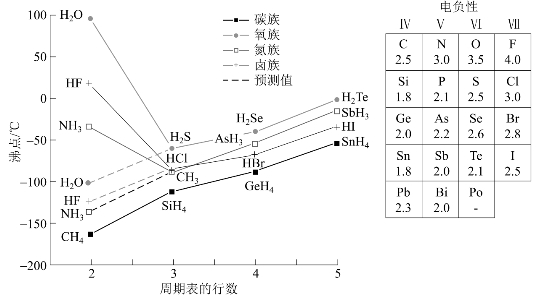
图3-45 氢化物的沸点变化曲线
对于同分异构体,一般来说,它们的范德华力是相同的。但如果分子中含有能生成氢键的结构,则其熔点、沸点等性质将相差很大。例如二甲醚(CH3 OCH3)和乙醇(CH3 CH2 OH)是同分异构体,但在乙醇分子中含有O—H键,分子间可形成氢键,常温下为液体;而二甲醚分子中没有能形成氢键的结构,分子间的作用力小,沸点很低。
又如,NH3分子与H2O分子间能形成氢键,所以氨气在水中有很大的溶解度;而PH3因不能与水分子形成氢键,所以在水中的溶解度很小。
此外,当一个分子可以在分子内形成氢键时,由于氢键具有饱和性,分子内氢键的形成将阻碍分子间氢键的形成,所以能形成分子内氢键的物质,其熔点、沸点降低,在水中的溶解度下降。如对硝基苯酚(图3-46(a))分子中硝基与羟基之间距离远,不能形成分子内氢键,但可以形成分子间氢键,且可以形成较大的缔合分子;而邻硝基苯酚(图3-46(b))中硝基与羟基能形成分子内氢键,间硝基苯酚(图3-46(c))不能形成分子内氢键,且由于空间位阻作用,只能形成较小的缔合分子,所以,对硝基苯酚比间硝基苯酚及邻硝基苯酚熔点高,三种物质熔点分别为114℃、96℃和45℃。
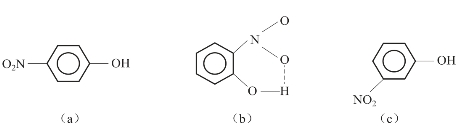
图3-46 硝基苯酚
(a)对硝基苯酚;(b)邻硝基苯酚;(c)间硝基苯酚
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




