分子间力(intermolecular force)就是分子与分子之间产生的相互作用力,由于这种力是范德华第一个提出来的,所以又称为范德华力(Van der Waals'force)。
1.取向力
取向力(orientation force)只存在于极性分子与极性分子之间。如图3-39所示。
当两个极性分子相互接近时,会产生同极相斥、异极相吸的作用,这种作用使得分子发生相对转动,结果使一个分子的正极与另一个分子的负极接近,系统中的分子将按极性的方向做定向排列。极性分子的这种运动称为取向,由于取向而产生的吸引力称为取向力。
取向力的本质是静电引力。分子的偶极矩越大,分子间静电引力越强,取向力就越大;系统的温度越高,分子的热运动越剧烈,分子的定向就越困难,取向力就越小;取向力随分子间距离增大而迅速减小。

图3-39 分子间作用力之取向力
2.诱导力
诱导力(induced force)存在于极性分子与非极性分子之间,也存在于极性分子与极性分子之间。
非极性分子在极性分子固有偶极的作用下,正、负电荷中心将产生相对位移,从而产生诱导偶极。这种现象在极性分子之间也存在,其结果使分子原有偶极加大。这种由于诱导而产生的作用力称为诱导力。诱导力产生的过程图示如图3-40所示。
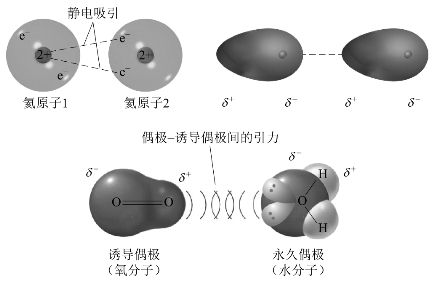
图3-40 诱导力产生过程(https://www.xing528.com)
诱导力的本质也是静电引力。极性分子的偶极矩越大,诱导作用越强,诱导力越大;非极性分子(或其他极性分子)的半径越大,产生的诱导偶极越大,诱导力越大;诱导力随分子间距离增大而迅速减小。
3.色散力
色散力(dispersion force)存在于任何分子之间,在分子间力的数值中占有相当大的比重。
色散力可看作分子的“瞬时偶极”相互作用的结果。在某一瞬间,因核及电子的运动,正、负电荷中心会出现暂时的不重合现象,由此使分子在瞬间产生的偶极就是瞬时偶极。瞬时偶极之间的相互吸引力称为色散力,又称为伦敦力(London force)。如图3-41所示。
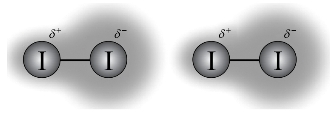
图3-41 伦敦色散力(I2键)
总之,在非极性分子之间只存在色散力;在极性分子与非极性分子之间存在着色散力和诱导力;在极性分子与极性分子之间存在着色散力、诱导力和取向力。三种力的总和称为分子间力,它是永远存在于分子之间的一种电性作用力。其作用能比化学键小1~2个数量级,作用范围一般只有300~500 pm;分子间力没有饱和性,也没有方向性。
在一般情况下,如分子的极性不是很大,则色散力远大于诱导力和取向力,表3-11列出了部分分子中各种分子间力的分配情况。
表3-11 分子间作用力及其分配情况
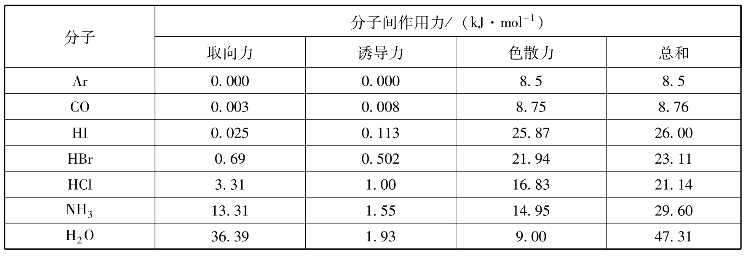
一般来说,结构相似的同系列物质相对分子质量越大,色散力越大,物质的熔沸点越高。例如稀有气体、卤素等,其沸点和熔点都是随着相对分子质量的增大而升高的。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




