配合物的价键理论是鲍林将杂化轨道理论应用于配合物中逐渐形成和发展起来的。该理论概念简单明确,能解释许多配合物形成体的配位数、配位个体的空间构型、磁性和稳定性。
价键理论认为:形成体与配体之间是通过配位键结合的,在形成配位个体时,形成体提供空轨道,配体提供孤电子对。为了提高成键能力,形成体提供的空轨道(s、p、d或s、p)必须先进行杂化,形成数目相等的杂化轨道。杂化轨道分别与配体中配位原子的孤电子对轨道在一定的方向彼此接近,发生最大程度的重叠,从而形成σ配位键,构成各种不同构型的配合物。
形成体的配位数、配位个体的空间构型和稳定性,主要取决于形成体所提供的杂化轨道的数目和类型。根据这个基本理论,可以解释各种构型的配位个体。
1.配位数为2的配位个体形成
实验测得[Ag(NH3)2]+配位个体中2个Ag+←NH3键的键能、键长相等,空间构型为直线形。
在[Ag(NH3)2]+中,形成体是Ag+,配体是2个NH3。在形成[Ag(NH3)2]+时,需要Ag+提供2个空轨道。Ag+的价层电子排布为4d105s05p0。4d轨道全满,5s轨道和5p轨道全空。在形成[Ag(NH3)2]+配位个体时,形成体Ag+提供了1个5s和1个5p空轨道进行sp杂化,得到具有直线形的2个等价的sp杂化轨道。两个配体NH3分子分别从两头沿直线与Ag+接近,N原子上的孤对电子填入空的sp杂化轨道,形成σ配位键,因此,[Ag(NH3)2]+配位个体具有直线形构型。[Ag(NH3)2]+配位个体的形成过程可用图3-27所示轨道图示表示。
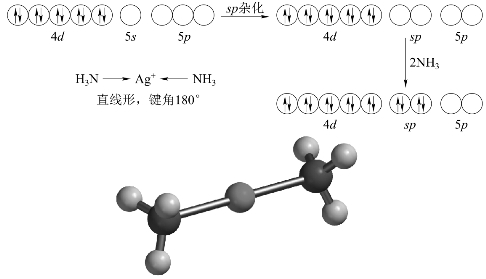
图3-27 [Ag(NH 3)2]+配位键的形成
2.配位数为4的配位个体形成
(1)[Zn(NH3)4]2+配位个体的形成
实验测得[Zn(NH3)4]2+配位个体中4个Zn2+←NH3键的键能、键长相等,空间构型为正四面体。
Zn2+的价层电子排布为3d104s04p0,外层有1个4s、3个4p共4个空轨道。价键理论认为,Zn2+与NH3形成[Zn(NH3)4]2+时,Zn2+外层空的1个4s轨道和3个4p轨道先进行sp3杂化,形成具有正四面体构型的4个等价的sp3杂化轨道,4个NH3分子中的N原子各提供一对孤电子对进入sp3杂化轨道,形成4个σ配位键。所以Zn2+的配位数是4,[Zn(NH3)4]2+空间构型为正四面体。[Zn(NH3)4]2+配位个体的形成过程可用图3-28所示轨道图示表示。
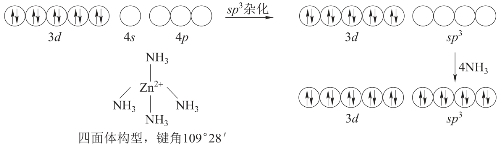
图3-28 [Zn(NH 3)4]2+配位键形成
(2)[Ni(CN)4]2-配位个体的形成
实验测得Ni2+具有顺磁性,[Ni(CN)4]2-配位个体具有反磁性,4个Ni2+←CN-键的键能、键长相等,空间构型为平面正方形。
Ni2+的价层电子排布为3d84s04p0,轨道中有2个自旋方向相同的未成对电子,因此具有顺磁性。但当Ni2+与4个CN-形成配位个体时,原来3d轨道上的2个未成对电子合并到1个3d轨道上,腾出了1个3d轨道,与外层的1个4s轨道和2个4p轨道杂化形成4个等价的dsp2杂化轨道,dsp2杂化轨道在空间的最小排斥是伸向平面正方形的4个顶角,键角90°,4个CN-中的C原子各提供一对孤电子对进入dsp2杂化轨道,形成4个σ配位键。Ni2+的配位数是4,[Ni(CN)4]2-空间构型为平面正方形,在[Ni(CN)4]2-中,电子均已成对,因此具有反磁性。[Ni(CN)4]2-配位个体形成过程可用图3-29所示轨道表示。
3.配位数为6的配位个体的形成(https://www.xing528.com)
(1)[FeF6]3-配位个体的形成
实验测得Fe3+与[FeF6]3-磁性相同,6个Fe3+←F-键的键能、键长相等,空间构型为正八面体。Fe3+的价层电子排布为3d54s04p0,含有5个自旋平行的未成对电子。由实验得知Fe3+与[FeF6]3-的磁性相同,说明Fe3+在形成配位个体前后未成对电子数没有发生改变。因此,在形成[FeF6]3-配位个体时,Fe3+是利用外层的1个4s轨道、3个4p轨道和2个4d轨道进行杂化,得到具有正八面体构型的6个等价的sp3 d2杂化轨道,分别接受F-提供的孤电子对,形成6个配位键,键角为90°,形成体Fe3+的配位数是6。[FeF6]3-配位个体的形成过程可用图3-30所示轨道图示表示。

图3-29 配位数为4的两种物型

图3-30 [FeF6]3-配位键形成
由于形成[FeF6]3-时,参与杂化的空轨道是同层的4s、4p和4d,故称[FeF6]3-为外轨型配合物(outer orbital coordination compound)。价键理论将形成体提供同层空轨道参与杂化而形成的配位键称为外轨型配位键,简称外轨配键,由此所形成的配合物称为外轨型配合物。
(2)[Fe(CN)6]3-配位个体的形成
实验结果表明,[Fe(CN)6]3-配位个体的空间构型也是正八面体,6个Fe3+←CN-键的键能、键长相等,但[Fe(CN)6]3-配位个体的磁性比Fe3+的磁性小。
价键理论认为,这是因为[Fe(CN)6]3-中的Fe3+在配体CN-的影响下,将其价层电子重排,原来3d轨道上的5个自旋平行的未成对电子中,有4个两两配对,自旋相反地分别挤入2个轨道中,剩余1个未成对电子占据一个轨道。空出2个3d轨道与外层的1个4s轨道和3个4p轨道进行d2 sp3杂化,得到6个等价的d2sp3杂化轨道,接受6个配体中的6个配位原子提供的6对孤电子对,形成σ配位键。因此,[Fe(CN)6]3-配位个体为正八面体构型,含有1个未成对电子(未成对电子数减少,其磁性减小),形成体的配位数为6。[Fe(CN)6]3-配位个体的形成过程可用图3-31轨道图示表示。

图3-31 [Fe(CN)6]3-配位键的形成
由于[Fe(CN)6]3-形成时,参与杂化的空轨道是3d、4s和4p,分别来自外层(n层)和次外层(n-1层),故称[Fe(CN)6]3-为内轨型配合物(inner orbital coordination compound)。价键理论将形成体提供外层和次外层空轨道参与杂化而形成的配位键称为内轨型配位键,简称内轨配键,由此所形成的配合物称为内轨型配合物。在形成内轨型配合物时,在配体的作用下,形成体次外层d轨道上的电子通常会发生重排或者跃迁,以腾出内层d轨道来参与杂化,如[Cu(NH3)4]2+、[Ni(CN)4]2-、[Co(NH3)6]3+等配位个体都是内轨型配合物。一般来说,当配体是CN-等离子时,容易形成内轨型配合物。内轨型配合物的键能大,配合物稳定,且在水中不易解离。
内轨型配合物的形成体成键轨道是d2 sp3杂化轨道,它比sp3 d2杂化轨道的能量低。因此,内轨型配合物比外轨型配合物更稳定。
形成体的价层电子构型是影响外轨型或内轨型配位个体形成的主要因素。如果形成体内层d轨道已全充满(如Zn2+:3d10,Ag+:4d10),没有可利用的内层空轨道,只能形成外轨型配合物;如果形成体本身具有空的内层d轨道(如Cr3+:3d3),一般倾向于形成内轨型配合物;如果形成体的内层d轨道未完全充满(d4~d7),则既可形成外轨型配合物,又可形成内轨型配合物,此时,配体是决定配合物类型的主要因素。
F-、H2O、OH-等配体中配位原子F、O的电负性较高,吸引电子的能力较强,不容易给出孤电子对,对形成体内层电子的排斥作用较小,基本不影响其价层电子结构,因而只能利用形成体的外层空轨道成键,倾向于形成外轨型配合物。
CN-、CO等配体中配位原子C、N的电负性较低,给出电子的能力较强,其孤电子对对形成体内层电子的排斥作用较大,内层电子容易发生重排(如Fe3+:3d5,Ni2+:3d8)或激发(Cu2+:3d9),从而空出内层d轨道,倾向于形成内轨型配合物。
配体为NH3分子时,既可能形成外轨型配合物,又可能形成内轨型配合物。如在[Co(NH3)6]2+配位个体中,形成体Co2+的价层电子构型为3d74s0,形成配位个体时,Co2+的3d轨道上的电子不能重排,采取sp3 d2杂化,形成外轨型配合物;而在[Co(NH3)6]3+配位个体中,形成体Co3+的价层电子构型为3d64s0,在配体NH3的作用下,Co3+的3d轨道上的电子发生重排,采取d2sp3杂化,形成内轨型配合物。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




