价层电子对互斥理论(Valence Shell Electron Pair Repulsion Theory),简称VSEPR法。这个理论在1940年由英国科学家西奇威克(N.V.Sidgwick)和美国科学家鲍威尔(H.M.Powell)首先提出,随后被加拿大科学家吉莱斯皮(R.J.Gillespie)和尼霍姆(R.S.Nyholm)进一步整理而成。虽然这个理论只是定性地说明问题,但对预测和推断AX n型(A为中心原子,X为配位原子,n为X的数目)多原子分子或离子的空间构型非常简便实用。
1.价层电子对互斥理论的基本要点
①AX n型分子或离子的空间构型取决于中心原子A的价层电子对数。中心原子A的价层电子对是指价层的σ键电子对和未参与成键的孤电子对。
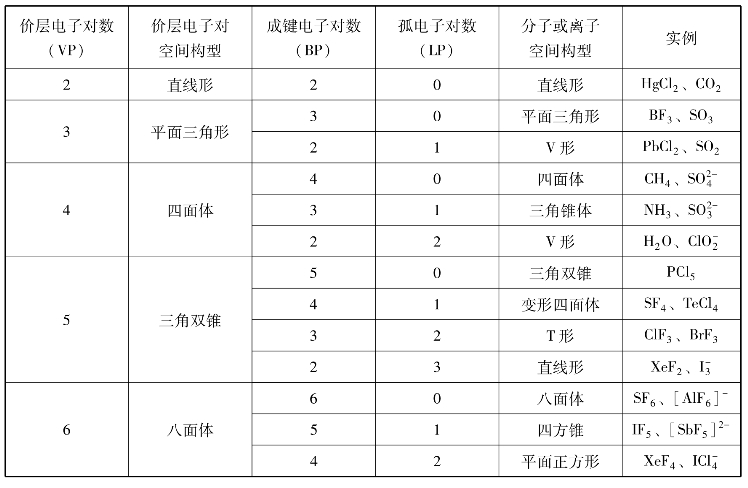
②中心原子的价层电子对之间尽可能相互远离,以使其斥力最小,并由此决定了AX n型分子或离子的空间构型。因此,中心原子的价层电子对数(VP)与价层电子对的空间构型之间的关系见表3-7。
表3-7 价层电子对数与价层电子对的空间构型

③价层电子对之间排斥力的大小与价层电子对数目、电子对的类型和电子对之间的夹角大小等因素有关,一般有以下规律:中心原子周围的价电子对数目越多,斥力越大。不同类型电子对间斥力大小有以下递变规律:孤电子对-孤电子对>孤电子对-成键电子对>成键电子对-成键电子对。
这是因为成键电子对受两个原子核的共同吸引,因此,它们离中心原子的平均距离较远,对中心原子周围的其他电子对的排斥作用小,而孤电子对因只受中心原子的原子核吸引,它的运动范围离中心原子的原子核近,在中心原子的原子核周围占据的空间大,从而对其他电子对的排斥作用强。这种斥力还与是否形成π键以及中心原子与配位原子之间的电负性有关,形成重键的数目不同,斥力也不同:三键>双键>单键。这是因为重键比单键所含电子数量多,对其他电子对的排斥作用强。电子对间夹角越小,斥力越大。一般,当电子对间夹角大于90°时,可不考虑电子对间斥力对分子空间结构的影响。
2.推断分子或离子空间构型的步骤
根据VSEPR理论,可按以下步骤推断分子或离子的空间构型。
首先需要确定中心原子的价层电子对数VP,推断价层电子对的空间构型。
对于AX n型分子或离子,其价层电子对数的确定方法为:
VP=1/2(中心原子价电子数+配位原子提供的价电子数±离子电荷数)
计算VP时有如下规定:
①中心原子价电子数等于该元素所处的族数。
②氢和卤素作为配位原子时,每个原子提供1个价电子,氧族元素作为配位原子可认为不提供价电子。(https://www.xing528.com)
③公式中的“±离子电荷数”,负离子取“+”号,正离子取“-”号。
④若计算价层电子对数的结果出现小数,则进为整数;双键、三键作为单键看待。
而后确定中心原子的孤电子对数LP、成键电子对数BP,推断分子或离子的空间构型。
若中心原子价层电子对数等于中心原子周围的配位原子数,则价层电子对都是成键电子对,价层电子对的空间构型就是该分子或离子的空间构型。如BeH2、BF3、SO2-4、PCl5、SF6分别是直线形、平面三角形、四面体、三角双锥和八面体。
若中心原子价层电子对中有孤电子对,分子或离子的空间构型将不同于价层电子对的空间构型。这时需要确定中心原子的成键电子对数BP、孤电子对数LP,通过分析各电子对之间相互排斥作用的大小,推断分子或离子的空间构型。其中孤电子对数LP等于价层电子对数VP减去成键电子对数BP,例如:NO2分子中N的价层电子对数近似为3,其中有两对是成键电子对,一个单电子当作一对孤对电子对,所以NO2分子的空间构型为V字形,O—N—O键角约为120°。表3-8列出了价层电子对与空间构型的关系。
表3-8 价层电子对与分子或离子空间构型的关系
3.影响键角的因素
价层电子对的空间构型既包括成键电子对,也包括孤电子对,而分子或离子的空间构型只考虑成键电子对数目以及周围的孤电子对对成键电子对空间结构的影响。如NH3分子价层电子对数为4,价层电子对的空间构型为四面体,但由于四面体的一个顶角被N原子的一对孤电子对占据,对邻近的成键电子对有较大的排斥作用,使价电子对的理想排布发生变形,键角变小,形成三角锥形的空间构型,键角为107.3°,小于109°28′。又如H2O分子,价层电子对的空间构型为四面体,而分子空间构型为V形,且键角由于受2对孤对电子影响而进一步被压缩为104.5°。
对含有双键或三键的分子或离子的空间构型进行推测时,可把重键当作一个单键对待。由于重键电子云在中心原子周围占据的空间比单键电子云大些,使斥力大小次序为:三键>双键>单键。
若中心原子(A)相同,随着配位原子电负性的增大,成键电子对的电子云将远离中心原子,对其他电子对的排斥作用减弱,键角变小。例如:NH3分子和NF3分子,由于F原子的电负性(4.0)比H的电负性(2.1)大,吸引成键电子对的能力强,NF3分子中成键电子对离N原子较远,因而NF3分子中成键电子对的排斥力小于NH3分子成键电子对的排斥力,所以NF3分子的键角(102°6′)小于NH3分子的键角(107°18′)。
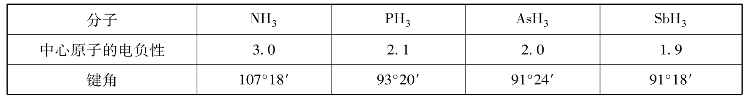
若配位原子(X)相同,随着中心原子电负性的增大,成键电子对的电子云将靠近中心原子,对其他电子对的排斥作用增强,键角将变大。见表3-9。
表3-9 中心原子电负性与键角关系
价层电子对互斥理论能成功地预测由第一、第二、第三周期元素所组成的多原子分子或离子的空间构型及键角变化等,但用此法判断含有d电子的过渡元素以及长周期主族元素形成的分子时常与实验结果有出入。同时,它也无法解释多原子分子中共价键的形成原因和相对稳定性。
以上讨论的价键理论、杂化轨道理论和价层电子对互斥理论,总的说来模型直观,比较好地解释了分子共价键的形成和分子的空间构型。但上述理论具有局限性,认为分子中的电子仍属于原来的原子,成键后的共用电子对只在两个成键原子之间的小区域内运动,没有把分子作为一个整体来全面考虑,因而遇到了不少困难。例如,按照价键理论,O2分子中的两个氧原子之间形成了一个σ键和一个π键,分子中所有的电子均已配对。但从O2分子的磁性实验可知,O2分子具有磁性,易被磁场吸引,这就说明在O2分子中含有未成对电子,这是价键理论无法解释的。又如,实验证明H+2可存在,即一个H原子和一个H+共用一个未成对电子,形成一个单电子的共价键,这也与价键理论中认为共价键的形成需要电子配对的基础相矛盾。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




