单纯用价键理论不能很好地解释分子的几何形状。如氧原子的基态电子排布为1s2 2s2![]() 两个p轨道上各有一个未成对的单电子,当与氢原子结合时,可以生成两个O—H共价键。但由于两个p轨道是相互垂直的,可以想象H2 O分子中H—O—H键角应该是90°。但是实验测量结果表明,H2 O分子中H—O—H键角实际是104.5°。再比如甲烷(methane)分子CH4,其具有正四面体形状,4个C—H共价键是完全等同的。为了较好地解释类似CH4、H2O这样的实验事实,1931年,鲍林在价键理论的基础上提出了杂化轨道理论(hybrid orbital theory)。
两个p轨道上各有一个未成对的单电子,当与氢原子结合时,可以生成两个O—H共价键。但由于两个p轨道是相互垂直的,可以想象H2 O分子中H—O—H键角应该是90°。但是实验测量结果表明,H2 O分子中H—O—H键角实际是104.5°。再比如甲烷(methane)分子CH4,其具有正四面体形状,4个C—H共价键是完全等同的。为了较好地解释类似CH4、H2O这样的实验事实,1931年,鲍林在价键理论的基础上提出了杂化轨道理论(hybrid orbital theory)。
原子在形成分子的过程中,中心原子在成键原子的作用下,其价层几个形状不同、能量相近的原子轨道改变原来状态,混合起来重新分配能量和调整伸展方向,组合成新的利于成键的轨道,这种原子轨道重新组合的过程就称为原子轨道的杂化(hybridization of atomic orbital),简称杂化。形成的新轨道称为杂化轨道(hybrid orbital)。杂化时,轨道的数目不变,轨道在空间的分布方向和分布情况改变,能级改变。组合得到的杂化轨道一般均和其他原子形成较强的σ键或在杂化轨道中安排孤对电子,而不会以空的杂化轨道形式存在。
杂化轨道的基本特点如下:原子轨道的杂化只发生在分子的形成过程中,是原子的外层轨道在原子核及键合原子的共同作用下发生的,孤立的原子不会发生杂化。杂化后,轨道在空间的分布使电子云更加集中,在与其他原子成键时重叠程度更大,成键能力更强,形成的分子更稳定。杂化轨道的数目和类型,取决于参加杂化的原子轨道的数目和种类,决定了杂化轨道分布的形状和所形成分子的空间构型。
1.杂化类型与分子空间构型
在形成分子的过程中,通常存在着激发、杂化、轨道重叠等过程。根据参加杂化的原子轨道的种类和数目的不同,可以组成不同类型的杂化轨道,形成不同构型的分子。
(1)sp杂化
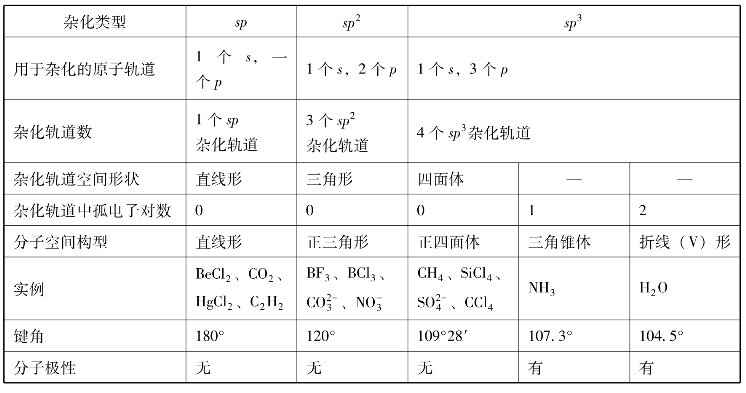
中心原子的1个ns轨道和1个np轨道杂化形成2个sp杂化轨道,每个sp杂化轨道含有1/2s成分和1/2p成分,杂化轨道间的夹角为180°,空间构型为直线形。
例如,气态的BeCl2分子中,Be原子的基态价层电子构型为2s2。成键时,Be原子的1个2s电子激发到2p轨道上,成为激发态2s12p1。Be原子的1个2s轨道与1个有1个电子占据的2p轨道进行sp杂化,形成2个能量相等、形状相同、伸展方向不同的sp杂化轨道,如图3-12所示。
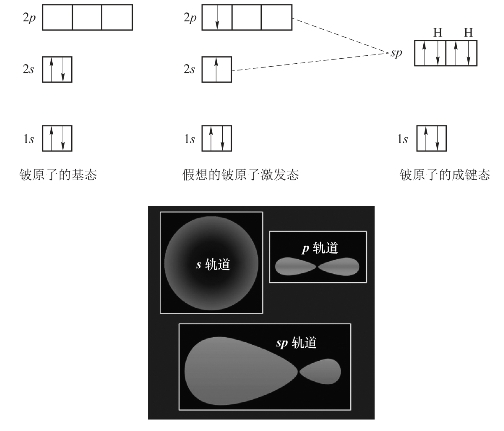
图3-12 sp杂化轨道的形成
2个sp杂化轨道分别与2个Cl原子的3p轨道重叠,形成2个sp-p型的σ键,如图3-13所示。
由于2个sp杂化轨道的夹角为180°,因此,形成的BeCl2分子的空间构型是直线形。杂化轨道理论对BeCl2分子结构的推测与实验测定的结果完全一致。
(2)sp2杂化
中心原子的1个ns轨道和2个np轨道杂化形成3个sp2杂化轨道,每个sp2杂化轨道含有1/3s成分和2/3p成分,杂化轨道间的夹角为120°,空间构型为平面三角形。
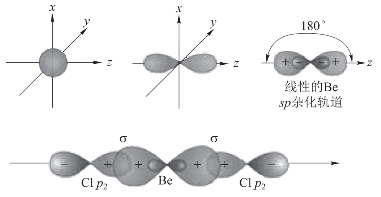
图3-13 BeCl2空间构型
例如,BF3分子中,B原子的价层电子构型为2s22p1,当B原子与F原子发生作用时,B原子中的1个2s电子被激发到一个空的2p轨道中,成为激发态![]() 这3个含有未成对电子的轨道进行sp2杂化,形成3个能量相等、形状相同、伸展方向不同的sp2杂化轨道,如图3-14所示。
这3个含有未成对电子的轨道进行sp2杂化,形成3个能量相等、形状相同、伸展方向不同的sp2杂化轨道,如图3-14所示。
3个sp2杂化轨道分别与3个F原子的2p轨道重叠,形成3个sp2-p型的σ键。因3个sp2杂化轨道处于同一平面上,且轨道夹角为120°,所以BF3分子具有平面三角形的结构。杂化轨道理论对BF3分子结构的推测与实验测定的结果完全一致。BF3分子的形成过程如图3-15所示。
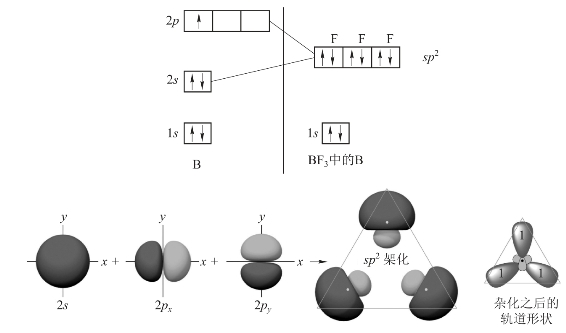
图3-14 sp2杂化轨道的形成
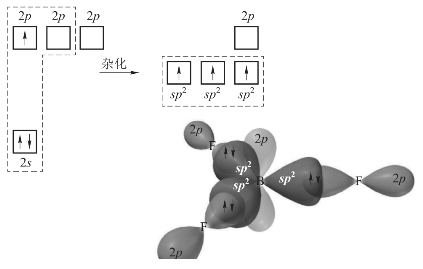
图3-15 BF3分子构型
(3)sp3杂化(https://www.xing528.com)
中心原子的1个ns轨道与3个np轨道杂化形成4个sp3杂化轨道,每个sp3杂化轨道含有1/4s成分和3/4p成分,杂化轨道间的夹角为109°28′,空间构型为正四面体。
例如,CH4分子中,当C原子与H原子发生作用时,C原子中的1个2s电子被激发到2px轨道中,形成了![]() 的价层电子构型,成键时,C的1个2s轨道和3个2p轨道进行sp3杂化,形成4个sp3杂化轨道,如图3-16所示。
的价层电子构型,成键时,C的1个2s轨道和3个2p轨道进行sp3杂化,形成4个sp3杂化轨道,如图3-16所示。
4个sp3杂化轨道分别与4个H原子的1s轨道重叠,形成4个sp3-s型的σ键。按最大重叠原理,4个C—H键分别指向正四面体的4个顶点,键角为109°28′,与实验测定的结果相符。CH4分子的形成过程如图3-17所示。
2.等性杂化和不等性杂化
前面介绍的几种杂化轨道都是能量和空间占有体积完全相同的杂化轨道,这样的杂化称为等性杂化(even hybridization)。但在H2O分子中,虽然中心O原子也采取sp3杂化,但有2个杂化轨道各含有1个未成对的电子,另外,2个杂化轨道则各含有1对电子,因此,它们在能量和空间占有体积上有所不同,这样的杂化称为不等性杂化(uneven hybridization)。
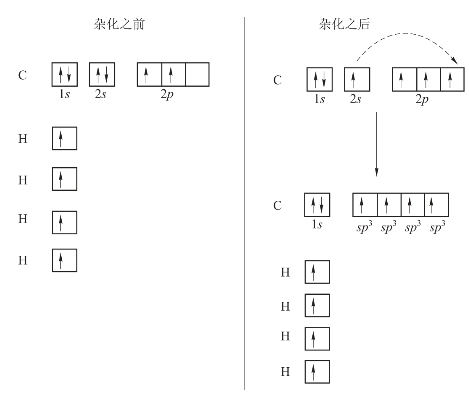
图3-16 sp3杂化轨道的形成
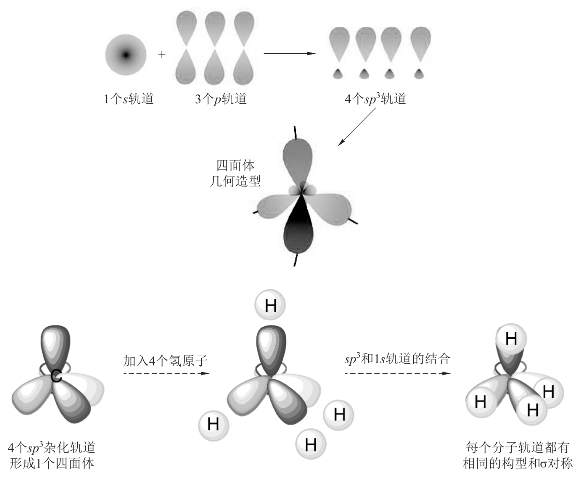
图3-17 CH 4的分子构型
O原子的2个含有未成对电子的杂化轨道分别与2个H原子的1s轨道重叠形成2个sp3-s型的σ键。由于孤电子对所占用的杂化轨道其电子云比较密集,因此,它对成键电子对所占用的杂化轨道起到排斥和压缩作用,结果使2个O—H键间的夹角被压缩成104.5°,而不是正四面体的109°28′,H2O的分子构型为V字形,电子构型为四面体。H2 O分子的形成过程如图3-18所示。
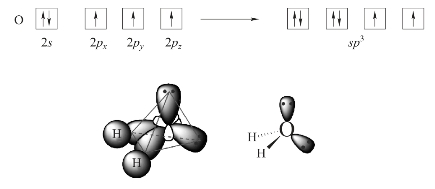
图3-18 H 2O分子的构型
除了水分子外,NH3分子中的N原子也是sp3不等性杂化,不同的是,只有1个杂化轨道含有1对电子,其余3个杂化轨道各含有1个电子,可形成3个σ键。因NH3分子中只有一对孤电子对,成键电子对所受的排斥和压缩作用小于水分子中的O—H键,所以N—H键之间的夹角为107.3°,大于水分子中O—H键间的夹角,NH3的电子构型为四面体,分子构型为三角锥体。NH3分子的形成过程如图3-19所示。
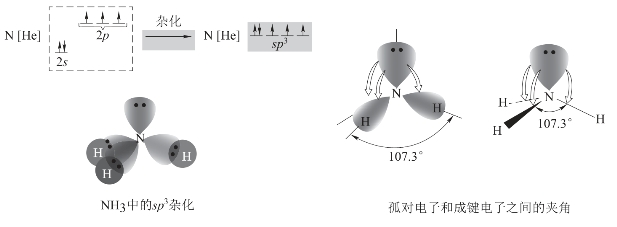
图3-19 NH 3分子构型
杂化轨道理论还可以解释一些分子的极性,例如BeCl2、BF3和CH4分子中的键属于极性键,但整个分子的正负电荷中心重合,为非极性分子;而H2O、NH3分子的正负电荷中心不重合,为极性分子。
图3-20和表3-6归纳总结了常见的几种轨道杂化形式。
在第三周期以后的元素原子中,其价层中除了含有s、p两种类型的轨道外,还含有d轨道,这些d轨道也能参与杂化,形成s-p-d类型的杂化轨道。
杂化轨道理论可以通过杂化轨道的类型,较好地解释多电子原子分子的空间构型,帮助人们了解这些分子的空间结构,继而掌握分子的性质。但对于任意一个共价分子,有时难于预测中心原子究竟采用什么杂化方式成键,因而影响了该理论的广泛适用性。
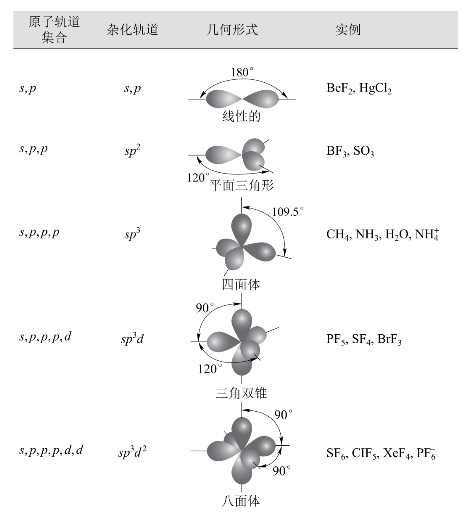
图3-20 常见的轨道杂化形式
表3-6 s-p杂化与分子构型
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




