1.共价键的形成
用量子力学处理H原子形成H2分子系统时,发现有两种情况:其一,当两个H原子的未成对电子的自旋方向相同时,随着两氢原子的逐渐靠近,两核间电子出现的概率密度降低,两原子核的排斥力增大,使系统的能量升高,这种状态称为排斥态(exclude state)。处于排斥态的两个原子核及两个电子之间的排斥作用大于原子核对另一个H原子中电子的吸引作用,在这种状态下将不能生成H2分子。其二,当两个氢原子的未成对电子的自旋方向相反时,随着两氢原子相互靠近,两核间形成一个电子概率密度较大的区域,使系统能量逐渐降低,两个原子的吸引作用要大于排斥作用,在核间距达到R0(平衡距离)时,系统能量最低,两个氢原子形成了稳定的氢分子,此种状态称为氢分子的基态(ground state)。当核间距小于平衡距离R0时,系统的能量随核间距的减小又迅速升高。所以,两个氢原子在核间距达到平衡距离时形成稳定的H2分子,即可以形成稳定的共价键。图3-8所示为核间距与系统能量的变化关系。
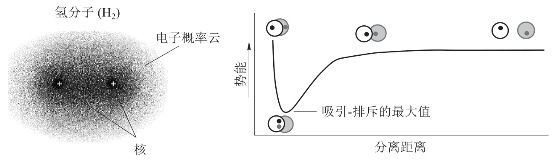
图3-8 两个氢原子核间距变化引发的系统能量变化
将量子力学处理氢分子的方法推广到双原子分子或多原子分子系统,即可得到价键理论的基本要点:
①两原子相互接近时,自旋反向的未成对电子可以配对形成共价键。
②成键电子的原子轨道重叠越多,所形成的共价键越牢固,这就是最大重叠原理(biggest overlap theory)。
2.共价键的特征
共价键的特征与前面讲的离子键特征恰好相反,共价键具有饱和性和方向性。
共价键具有饱和性(saturated covalent bond),是指已键合的电子不再形成新的共价键,即一个原子所能形成的共价键的数目是受未成对电子(包括原子在激发后形成的未成对电子)数限制的。共价键的饱和性是由于原子外层未成对电子及其占有的轨道数目有限而造成的,是由成键原子的价层电子结构决定的。两个原子之间如只有一对共用电子,形成的化学键称为单键;若两个原子间有两对共用电子对,就称为双键;若有三对共用电子对,就称为三键。
共价键具有方向性(directional covalent bond),是说共价键的形成在可能范围内,原子轨道的重叠一定采取电子云密度最大的方向。除s原子轨道外,p、d原子轨道在空间都有自己特定的伸展方向,因此,在形成共价键时,只有沿着这些原子轨道的空间伸展方向重叠,才能达到最大程度的重叠,形成的共价键才能达到最稳定的状态,形成稳定的共价键。
例如,在形成HCl分子时(图3-9),H原子的1s轨道只有在沿着Cl原子的未成对电子所占的p轨道的空间伸展方向上接近Cl原子,才能达到最大程度的重叠,形成稳定的共价键。由于原子轨道具有一定的空间伸展方向,为了满足最大重叠原理,使得轨道重叠后所生成的共价键具有一定的方向性。共价键的方向性决定了共价化合物分子的空间构型,进而对分子的性质产生了重大的影响。
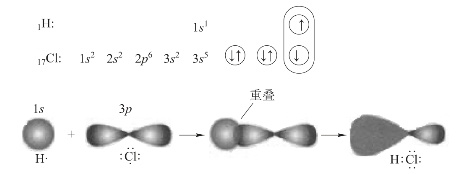
图3-9 s和p轨道的重叠形式
3.共价键的类型
按原子轨道重叠方式的不同,共价键可以分为σ键和π键两种类型。
σ键是原子轨道沿着键轴(两原子核间连线)方向以“头碰头”的方式发生重叠所形成的共价键。形成σ键的原因是:s-s重叠;s-p重叠;pz-pz重叠。形成σ键时,轨道的重叠部分对于键轴呈圆柱形对称,沿键轴方向旋转任意角度,轨道的形状和符号均不发生改变。
π键是原子轨道沿着键轴方向以“肩并肩”的方式发生重叠所形成的共价键。形成π键时,轨道的重叠部分对通过键轴的平面呈镜面反对称,如图3-10所示。
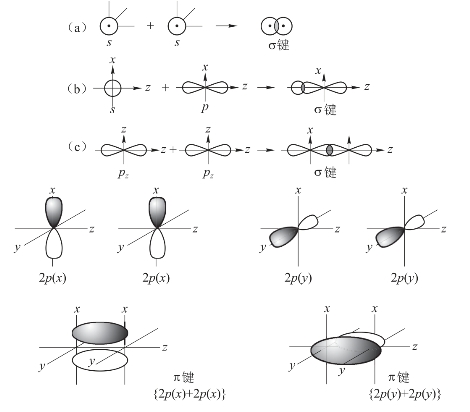
图3-10 σ键和π键
在两种重叠方式中,由于“头碰头”的重叠比“肩并肩”的重叠程度大,因此,σ键的键能大,稳定性高;π键的键能相对小,稳定性较低,是化学反应的积极参与者。(https://www.xing528.com)
当两个原子形成共价单键时,原子轨道总是沿键轴方向达到最大程度重叠,所以单键都是σ键,形成共价双键时,有一个σ键和一个π键;形成共价三键时,有一个σ键和两个π键。例如N2分子,N的价层电子构型为2s22p3,有3个未成对的p电子![]() 两个N原子沿键轴(x轴)相互接近时,形成σ(px-px)、π(py-py)和π(pz-pz)3个共价键(两个π键互相垂直),如图3-11所示。
两个N原子沿键轴(x轴)相互接近时,形成σ(px-px)、π(py-py)和π(pz-pz)3个共价键(两个π键互相垂直),如图3-11所示。
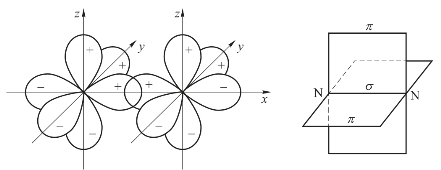
图3-11 N2的共价三键示意图
4.共价键的参数
表征共价键特性的物理量称为共价键参数,简称键参数(bond parameter)。键参数通常指键能(bond energy)、键长(bond length)、键角(bond angle)和键的极性(bond polarity)等。
(1)键能
键能指气态分子断裂单位物质的量(1 mol)的某键时的焓变,如:
![]()
上式即表示298.15 K、标准态下,H—Cl键的键能E=431 kJ·mol-1。
根据能量守恒定律:断裂化学键所需的能量=形成该键时释放出的能量。所以,键能可以作为衡量化学键牢固程度的键参数。键能越大,共价键越牢固,分子越稳定。对于双原子分子来说,键能(E)在数值上等于键的解离能(D)。对于多原子分子来说,键能(E)等于解离能(D)的平均值。
(2)键长
分子内成键两原子核间的平衡距离称为键长。键长越短,键的稳定性越高。几种键的键长和键能见表3-5。
表3-5 几种键的键长和键能
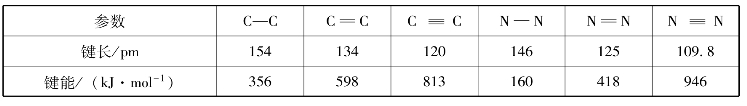
双键键长是单键键长的85%~90%,三键键长为单键键长的75%~80%。
(3)键角
在分子中,键与键之间的夹角称为键角。键角是反映分子空间结构的一个重要因素。例如,H2O分子中两个O—H键之间的夹角为104.5°,这就决定了H2O分子的V形结构;NH3分子中3个N—H键之间的夹角为107.3°,从而决定了NH3分子的三角锥体结构。
(4)键的极性
按共用电子对是否发生偏移,共价键可分为非极性共价键(non-polar covalent bond)和极性共价键(polar covalent bond),简称非极性键和极性键。
同种元素的原子形成的共价键因两原子的电负性相同,正、负电荷中心重合,属非极性键。异种元素的原子形成的共价键,由于两个原子的电负性不同,共用电子对偏向于电负性较大的原子,导致共价键中正、负电荷中心不重合,属极性键。共价键的极性与成键原子的电负性差值有关,电负性差值越大,共价键的极性就越大。
离子键是化学键的一个极端,由于成键的两个原子的电负性差值足够大,它们对电子的吸引能力的差别使得电负性小的原子中的电子转移到电负性大的原子上,从而形成了带正电荷的正离子和带负电荷的负离子。而非极性键是化学键的另一个极端,组成化学键的两个原子的电负性差值为零,对电子的吸引能力相等,正、负电荷中心重合。在上述两者之间存在着一系列极性不同的共价键。共价键的极性对分子的物理、化学性质具有很大的影响。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




