离子的极化(Ionic polarization)由法扬斯(Fajans)首先提出。离子极化指的是在离子化合物中,正、负离子的电子云分布在对方离子的电场作用下,发生变形的现象。对孤立的简单离子来说,离子的电荷分布基本上是球形对称的,离子本身的正、负电荷中心是相互重合的,不存在偶极。当把离子置于电场中,离子中的原子核就会受到正电场的排斥和负电场的吸引,而离子中的电子则会受到正电场的吸引和负电场的排斥,从而使离子中的正、负电荷中心不重合,离子发生变形,产生诱导偶极,这个过程称为离子的极化。图3-6所示为离子极化过程。图中,d0表示初始的离子间距。
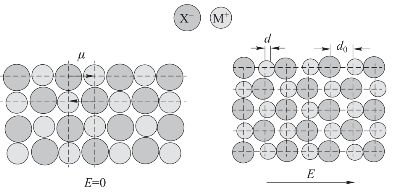
图3-6 离子极化示意图
由于在离子晶体中,正、负离子本身带有电荷,也能产生电场,因此,离子在周围带相反电荷离子的作用下,原子核与电子发生相对位移,导致离子变形而产生诱导偶极。所以,在离子化合物中,每个离子都会发生极化现象。
离子极化的强弱取决于两个因素:离子极化力和离子的变形性。
1.离子极化力(polarization force)
离子的极化力是指离子使带相反电荷离子极化而发生变形的能力。影响离子的极化力的因素有离子的半径、电荷数和电子构型。
①离子的半径:当离子的电荷数和电子构型相同时,离子的半径越小,产生的电场越强,极化力越大,例如:Mg2+>Ba2+,Na+>K+。
②离子的电荷数:当离子半径相近时,正离子的电荷数越高,产生的电场强度越大,极化力越强,例如:Si4+>Al3+>Mg2+>Na+。
③离子的电子构型:当离子电荷相同、半径相近时,离子的电子构型对离子的极化力就起决定性的影响。其强弱有下列关系:18+2,18,2电子构型>9~17电子构型>8电子构型。
2.离子的变形性(deformation of ions)
离子的变形性是指离子被相反电荷极化而发生变形的能力。离子变形性的大小取决于离子的半径、电荷数和电子构型。
①离子的半径:当离子的电荷数和电子构型相同时,离子的半径越大,变形性越大,例如:I->Br->Cl->F-。
②离子的电荷数:当离子的电子构型相同时,负离子的电荷数越高,变形性越大;而正离子的电荷数越高,变形性越小。如下列离子的变形性顺序为:O2->F->(Ne)>Na+>Mg2+>Al3+>Si4+。
③离子的电子构型:当离子电荷相同、半径相近时,离子的电子构型对离子的变形性就起决定性的影响。其大小有下列关系:18+2,18,9~17电子构型>8电子构型。
总的来说,最容易变形的离子是体积大的负离子。18或18+2电子构型以及不规则电子层的少电荷正离子的变形性也是相当大的。最不容易变形的离子是半径小、电荷高、外层电子少的正离子。
由于正离子的半径小、极化力大、变形性小,而负离子半径大、极化力小、变形性大,因此,在讨论离子极化时,主要考虑正离子的极化力和负离子的变形性。
3.离子的极化规律
正离子对负离子的极化作用即正离子使负离子变形,产生诱导偶极的规律如下:
①负离子半径相同时,正离子所带的电荷越多,负离子越容易被极化,产生的诱导偶极越大。
②正离子电荷相同时,正离子的半径越小,负离子被极化的程度越大,产生的诱导偶极越大。(https://www.xing528.com)
③正离子电荷相同、半径相近时,负离子半径越大,越容易被极化,产生的诱导偶极越大。
当正离子和负离子一样,也容易发生变形时,如电子构型为18和18+2的正离子,此时除要考虑正离子对负离子的极化外,还必须考虑负离子对正离子的极化作用,即附加极化。
4.离子极化对物质的结构和性质的影响
(1)离子极化对化学键类型的影响
正离子与负离子之间如果完全没有极化作用,则所形成的化学键为离子键。但是,实际上正离子与负离子之间存在不同程度的极化作用。当极化力强、变形性又大的正离子与变形性大的负离子相互接触时,由于正、负离子相互极化作用显著,负离子的电子云将向正离子方面偏移,同时,正离子的电子云也会发生相应变形。结果使正、负离子之间的核间距减小,其外层轨道发生不同程度的重叠,键的极性减弱,从而使键型由离子键向共价键方向过渡。如图3-7所示。
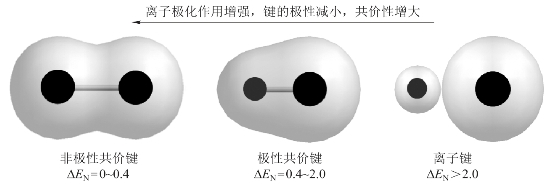
图3-7 离子极化对键型的影响
离子极化导致键型的改变可以AgX为例加以说明。Ag+为18电子构型,极化力和变形性都较大,而卤素离子从F-→I-的半径逐渐增大,变形性增强。变形性较小的F-与Ag+形成的化学键是典型的离子键。随着卤素离子半径的加大,离子的变形性增加,受Ag+的极化作用增强,形成的化学键的极性减弱。所以,AgCl、AgBr中的化学键是兼有离子键和共价键性质的过渡键型,而AgI的化学键已是较典型的共价键了。表3-3中列出了卤化银键长、键型等数据。
表3-3 卤化银的键型

AgX键型变化说明:离子键和共价键之间没有绝对的分界线,很多化学键中都含有部分离子键成分和部分共价键成分,只是含有这两种键的成分多少不同而已。即使是典型的离子键,也含有一定的共价键成分;同样,典型的共价键也含有部分的离子键成分。
(2)离子极化对晶体构型的影响
晶体中的离子在其平衡位置附近不断地、有规律地振动着,当离子离开其正常位置而稍偏向某异电荷离子时,将会产生诱导偶极,导致以下两种结果:在正离子极化力不大,负离子的变形性也不大的情况下,由于极化作用不显著,在热运动的作用下,该离子将能回到原来的正常位置,离子晶体的晶体构型维持不变;如果正离子的极化力大,负离子的变形性也大时,正、负离子之间的强极化作用缩短了离子间的距离,使晶体向配位数减小的晶体构型转变。
表3-4 卤化银的正、负离子半径比、晶型和配位数

由表3-4可知,AgF的r+/r-虽然大于0.732,但因Ag+与F-之间有一定的极化作用,使其晶体构型不是CsCl型,而是NaCl型。AgI的r+/r-虽然大于0.414,但由于Ag+的极化力大、I-的变形性大,使得AgI的实际晶体结构为ZnS型,而不是NaCl型。
实际上,由于离子极化现象的普遍存在,典型的离子化合物并不太多,大多数所谓的离子化合物是介于离子键和共价键之间的过渡键型化合物。
(3)离子极化对物质物理性质的影响
离子极化作用,使化学键由离子键向共价键过渡,引起晶格能降低,导致化合物的熔点和沸点降低。如AgCl和NaCl,两者晶型相同,但Ag+的极化能力大于Na+的,导致键型不同,所以AgCl的熔点是455℃,而NaCl的熔点是801℃。又如HgCl2,Hg2+是18电子构型,极化能力强,又有较大的变形性,Cl-也具有一定的变形性,离子的相互极化作用使HgCl2的化学键有显著的共价性,因此,HgCl2的熔点为276℃,沸点为304℃,都较低。
离子极化作用对物质的溶解度也会产生较大的影响,离子间的极化作用越强,化学键的共价成分越多,物质在水中的溶解度越小。例如,在银的卤化物中,由于F-半径很小,不易发生变形,所以AgF是离子型化合物,它可溶于水。而对于AgCl、AgBr和AgI,随着Cl-、Br-和I-的半径依次增大,变形性也随之增大。Ag+的极化能力很强,所以这三种化合物都具有较大的共价性。AgCl、AgBr和AgI的共价程度依次增大,故溶解度依次减小。
离子极化作用也是影响化合物颜色的重要因素之一。一般情况下,如果组成化合物的两种离子都是无色的,那么这个化合物也无色,如NaCl、NaNO3等。如果其中一个离子是无色的,另一个离子有颜色,则这个离子的颜色就是该化合物的颜色,如K2CrO4呈黄色。但比较AgI和KI时发现,AgI是黄色而不是无色。这显然与Ag+具有较强的极化作用有关,因为极化作用导致AgI吸收部分可见光,从而呈现颜色。总之,极化作用越强,对于化合物的颜色影响越大,所以,AgCl、AgBr和AgI随着正、负离子相互极化作用的增强,其颜色由白色到淡黄色再到黄色。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




