1.离子晶体的形成
如果把离子看作是刚性的圆球,则离子在空间堆积时,它们之间的作用力会尽可能地使它们占有最小的空间,这就是密堆积原理。离子晶体的结构可以看作是离子的密堆积构成的,一般负离子半径较大,负离子密堆积,半径小的正离子填在负离子密堆积所形成的空隙里。
2.离子晶体的性质
①无确定的相对分子质量。离子晶体不存在分子,如NaCl晶体是由无数Na+和Cl-组成的大分子,晶体中无单独的NaCl分子存在。NaCl是分子式(最简式,empirical formula),因而58.5可以认为是摩尔质量,不是相对分子质量。
②导电性。虽然离子化合物由带电粒子组成,但是在固态中,这些带电粒子的迁移率很小。因此,离子晶体是电的不良导体。水溶液或熔融态离子晶体可导电,是通过离子的定向迁移完成的,而不是通过电子流动导电的。
③熔点沸点较高。由于把离子晶体束缚在一起的静电引力相当大,因此,晶体的熔点和沸点都相当高。离子的电荷增加,熔点和沸点都增加。
④硬度高、延展性差。因离子键强度大,所以硬度高。但受到外力冲击时,易发生错位,导致破碎。受力时发生错位,使正正离子相切,负负离子相切,彼此排斥,离子键失去作用,故离子晶体无延展性。如CaCO3可用于雕刻,但不能用于锻造,因为CaCO3不具有延展性。
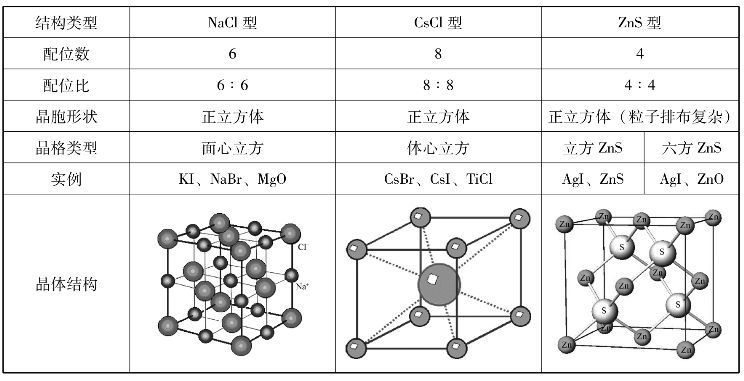
3.离子晶体的最简单结构类型
离子晶体中,正、负离子在空间的排布情况不同,离子晶体的空间构型也不同。最简单的立方晶系AB型离子晶体的3种典型的结构类型及特征见表3-2。同是离子晶体,具有不同的配位数,可用离子的堆积规则解释。
表3-2 AB型离子晶体的结构类型及特征
4.离子晶体的半径比定则
在AB型离子化合物中,离子晶体的结构类型与正、负离子的半径大小、离子的电荷及离子的价层电子构型有关。其中,与正、负离子半径的相对大小的关系最为密切,因为只有当正、负离子能紧密接触,同时,同性离子尽可能远离时,所形成的离子晶体的构型才是最稳定的。通常情况下,负离子因核外电子数多,电子间的排斥作用大,使得负离子的半径较大;而正离子因核外的电子数少,电子之间的排斥作用小,半径通常较小。在配位数为6的面心立方晶格中,某一层的离子如图3-5所示。(https://www.xing528.com)
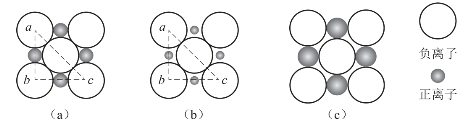
图3-5 半径比与配位数的关系
图3-5(a)中正、负离子相切,同时,负离子与负离子也相互接触。若负离子的半径为r-,正离子的半径为r+,则有

因而
![]()
所以
r+/r-=0.414
即当正、负离子半径的比值为0.414时,在同一平面中,负离子周围有4个正离子,另外,上、下两层各有1个正离子,所以,此时晶体中离子的配位数为6。
当r+/r-<0.414时(图3-4(b)),负离子相互接触,而正、负离子分离。这时离子间的排斥力将大于吸引力,晶体不能稳定存在,此时晶体中的配位数将降低,即正离子周围的空间只能容纳4个负离子,即形成了ZnS型晶格的离子晶体。如再有负离子接近正离子,将使正、负离子之间的间距加大,晶体的能量升高。
当r+/r->0.414时(图3-4(c)),正、负离子相互接触,而负离子之间有一定的空隙,这种结构较为稳定,此时正、负离子的配位数为6。当r+/r-增大时,正离子的半径相对增大,它周围的空间也随之增大,由于离子键没有饱和性,所以每个离子都有吸引更多异性离子的倾向。如r+/r-进一步增大到0.732以上时,正离子周围的空间足够容纳8个负离子,此时形成配位数为8的CsCl型晶格将更稳定。
利用正、负离子的半径比可以判断离子的晶格类型。当r+/r-<0.414时,离子的配位数为4,形成ZnS型晶格;当0.414<r+/r-<0.732时,离子的配位数为6,形成NaCl型的晶格;而当r+/r->0.732时,形成配位数为8的CsCl型的晶格。
应用离子的半径比定则判断离子化合物晶体的构型时,应注意以下问题:当离子的半径比处于极限值附近时,该化合物可能有两种构型;离子型化合物的正、负离子半径比定则只能应用于离子型晶体,而不能用它判断共价型化合物的结构。离子晶体的构型除了与正、负离子的半径比有关外,还与离子的电子构型有关。离子的电子构型对离子晶体性质的影响,需从离子极化的角度来说明。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




