1.离子键的形成
当电负性较小的活泼金属原子与电负性较大的活泼非金属原子在一定条件下相互接近时,金属元素的原子容易失去最外层电子,形成具有稀有气体稳定电子结构的正离子;而非金属元素的原子容易得到电子,形成具有稀有气体稳定电子结构的负离子;正、负离子之间除了静电相互吸引力外,还存在着电子之间、原子核之间的相互排斥力。当正、负离子接近到一定距离时,吸引力和排斥力达到平衡,系统的能量达到最低,这时,正、负离子在平衡位置附近振动,形成了稳定的化学键。这种正、负离子间通过静电作用所形成的化学键称为离子键(ion bond)。正负离子也可以由多原子组成,如![]() 等。离子键的本质是正、负离子间的静电作用力。
等。离子键的本质是正、负离子间的静电作用力。
以NaCl为例,离子键的形成过程可简单表述如下:
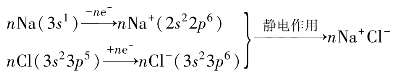
由离子键结合所形成的化合物称为离子型化合物(ionic compound)。在元素周期表中,碱金属和碱土金属(Be除外)与卤素、氧等形成的化合物是典型的离子型化合物。一般来说,元素的电负性差值越大,形成的离子键越强。当两种元素的电负性差值为1.7时,它们之间形成的单键离子性约有50%,因此,一般把元素电负性差值大于1.7时形成的化学键看成是离子键。
需要说明的是,原子失去电子成为离子,失去电子的次序并不是电子填充原子次序的逆反,而是取决于整个离子能量的高低。原子失去电子的次序可用(n+0.4l)来估算,即np先于ns,ns先于(n-1)d。如Fe[Ar]3d64s2,变成Fe2+,先失去4s电子而不是3d电子。这是由于原子失去电子后,电子数目减少,排斥作用相对减少,核的吸引能起主要支配作用,因此,主量子数作用显著,使4s能级高于3d能级,故先失去4s电子。
2.离子键的特点
离子键的特征是无方向性(non-orientation)和无饱和性(non-saturation)。
离子键无方向性是说在离子型化合物中,一个正离子对它周围所有的负离子有相同的吸引力,同理,一个负离子对它周围所有的正离子也有相同的吸引力,并不存在某一方向上相反离子静电作用更大的问题。这是因为离子的电荷分布具有球形对称的结构,因此,正离子与负离子可以从各个方向相互接近而形成离子键。
离子键无饱和性是说在形成离子键时,只要空间条件允许,每一个离子可以吸引尽可能多的电荷相反的离子,并不受离子本身所带电荷的限制。一个离子周围到底能有多少带相反电荷的离子,受离子的半径、离子电荷数等多种因素影响。如NaCl晶体中,每个Na+周围有6个Cl-,同时,每个Cl-周围也有6个Na+。如图3-3所示。
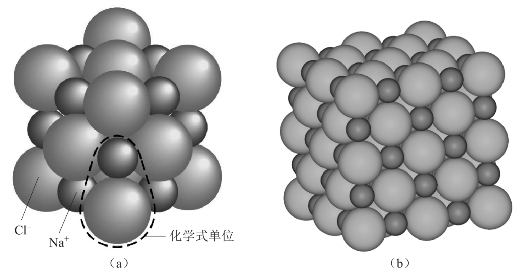
图3-3 氯化钠晶体结构
基于离子键以上的特征,在离子晶体中无法分辨出一个个独立的“分子”,例如在NaCl晶体中,不存在所谓的NaCl分子。所以,NaCl只是氯化钠的化学式,而不是分子式。
3.离子的结构
离子的结构是指离子的电荷数、离子的半径和离子的电子构型。
(1)离子的电荷数
离子的电荷数与原子结构相关。在形成离子键时,原子在达到8电子(或2电子)结构、形成离子时失去或得到的电子数称为离子的电荷数。从离子键的形成过程可知,正离子的电荷数是原子失去相应电子达到8电子(或2电子)结构后形成的,而负离子的电荷数则是原子获得相应电子达到8电子(或2电子)结构后形成的。正、负离子的电荷数主要取决于相应原子的核外电子排布、电离能和电子亲和能等。
离子的电荷是影响离子化合物性质的重要因素。离子电荷越高,对相反电荷离子的静电引力越强,因而化合物的熔点就越高。如CaO的熔点(2 590℃)比KF的熔点(856℃)要高得多。
(2)离子半径
与原子一样,单个离子也不存在明确的界面。所谓离子半径,是根据晶体中相邻正、负离子的核间距(d)测出的,核间距可以看作正、负两个相邻离子的半径之和。(https://www.xing528.com)
离子半径具有如下规律(图3-4):同一周期中,主族元素随着族数的增加,正离子的电荷数增大,核对外层电子的吸引作用增强,离子半径依次减小;同一主族元素,自上而下,因电子层数依次增加,所以具有相同电荷数的同族离子的半径依次增大;同一元素负离子半径大于原子半径,正离子半径小于原子半径;且正离子所带电荷数越多,离子半径越小;负离子所带电荷数越多,离子半径越大。
离子半径的大小直接影响离子间吸引作用的强弱,半径较小的离子所形成的离子键的核间距小,正、负离子的吸引作用大,形成的离子化合物的熔、沸点高,硬度大。
(3)离子的电子构型
所有简单负离子(如F-、Cl-、S2-)的最外电子层,都有8个电子(ns2np6)的稳定的稀有气体型结构。而正离子的情况比较复杂,其电子构型有以下几种:
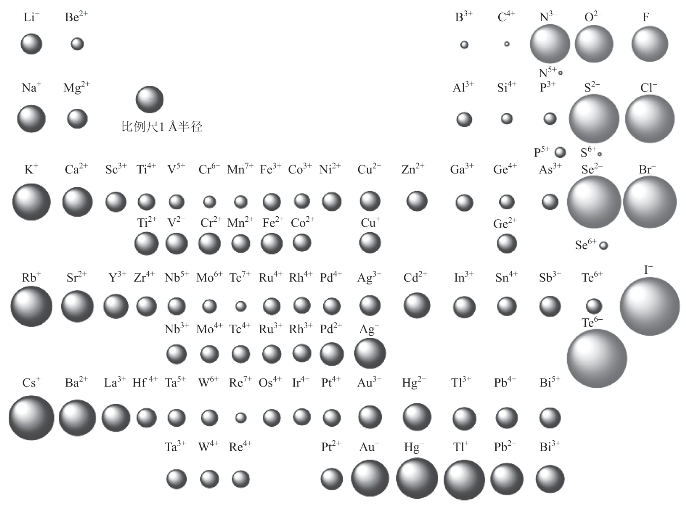
图3-4 相对离子半径示意图
①2电子构型:最外层电子数为2个电子的离子(ns2),如Li+、Be2+等;
②8电子构型:最外层电子数为8个电子的离子(ns2np6),如Na+、Mg2+、Al3+等;
③18电子构型:最外层电子数为18个电子的离子(ns2np6nd10),如Ag+、Hg2+等;
④18+2电子构型:次外层电子数为18个电子,最外层为2个电子的离子[(n-1)s2(n-1)p6(n-1)d10ns2],如Pb2+、Sn2+、Bi3+等。
⑤9~17电子构型:最外层电子数在9~17之间,又称不饱和电子构型(ns2np6nd1~9),如Fe3+、Mn2+、Cu2+等。
4.离子键的强度
离子键的强度可以用离子键的键能(bond energy)来表示,也可以用离子晶体的晶格能(lattice energy)来表示。
(1)用离子键的键能表示
在298.15 K和标准态下,将1 mol气态离子化合物离子键断开,使其分解成气态中性原子(或原子团)时所需要的能量,称为该离子键的键能,用符号E表示,例如:
![]()
即键能E=398 kJ·mol-1。离子键的键能越大,键的稳定性越高。
(2)用离子晶体的晶格能表示
离子晶体的晶格能的定义是:在标准态下,将1 mol离子型晶体(如NaCl)拆分为1 mol气态正离子(Na+)和1 mol气态负离子(Cl-)所需要的能量,用符号U表示,单位为kJ·mol-1。离子晶体的晶格能是衡量离子键强度的标志,晶格能越大,离子键越强,晶体越稳定;晶格能越大,熔化或破坏离子晶体时消耗的能量也就越多,晶体的熔点越高,硬度越大,热膨胀系数越小,压缩系数越小。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




