化学键(chemical bond)讨论的是分子或晶体中相邻原子或离子之间的结合方式。根据分子或晶体中电子的运动方式不同,化学键分为离子键(ionic bond)、共价键(covalent bond)和金属键(metal bond)。
通过不同类型的化学键结合形成的物质结构不同,所表现出的各自特征和性质也不相同。物质是由分子组成的,分子是保持物质性质的最小微粒,也是物质参与化学反应的基本单元。因此,研究物质性质及其变化的根本原因,必须进一步研究物质的微观结构,研究物质的微观结构就是研究物质的分子结构。分子的结构通常包含以下几个方面:
①分子中直接相邻的原子或离子间的强相互作用力,即化学键;
②分子中的原子或离子在空间的排列,即空间构型(geometry configuration),也称几何构型(geometric configuration);
③分子之间的弱相互作用力,包括范德华力(Vander Waals force)和氢键(hydrogen bond)的作用力;
④分子的结构与物质性质的联系。
本章将在原子结构的基础上,讨论上述4个方面所涉及的基本理论和基础知识,这对于掌握物质性质及其变化规律具有十分重要的意义。为了更好地理解物质结构,在这里,需要先介绍一些晶体的基本规律和知识。
物质通常有气、液、固三种聚集状态。其中固体物质可分为晶体(crystal)和非晶体(non-crystal)。晶体是指物质的内部质点(分子、原子或离子)在空间按一定规律周期性重复排列所构成的固态物质,如氯化钠、石英等。晶体又可分为单晶(single crystal)和多晶(polycrystal):单晶是指整个晶体内部都按一定的规律排列;多晶是许多单晶的集合体(或聚集体)。非晶体又称为无定形体(amorphous solid),其内部质点的排列没有规律,如玻璃、松香、石蜡、沥青等均属非晶体。
与非晶体相比,晶体具有以下三个特征。
(1)有一定的几何外形
晶体在生长过程中,将自发地形成晶面。晶面相交形成晶棱,晶棱相会形成晶角,从而使形成的晶体一般都有一定的几何外形。非晶体,如玻璃、石蜡等没有一定的几何外形,称为无定形体。由极微小晶体组成的物质称为微晶体(micro crystal)。如炭墨和化学反应刚析出的沉淀等,从外观看不具有整齐的外形,但仍属晶体的范畴。
(2)有固定的熔点
在一定的压力下,将晶体加热,当达到某一温度(熔点)时,晶体开始熔化。在晶体没有完全熔化前,即使继续加热,晶体本身的温度也不会上升,而是保持恒定;只有当晶体完全熔化后,系统的温度才会重新上升。非晶体没有固定的熔点,只有一段软化的温度范围,如松香在50℃~70℃之间软化。
(3)各向异性(https://www.xing528.com)
晶体的某些性质,如光学性质、力学性质、导热导电性、溶解性等,从晶体的不同方向测定时,常常是不同的。晶体的这种性质称为各向异性(anisotropy)。造成晶体各向异性的原因是晶体内部微粒排列是有次序和有规律的,并按某些确定的规律重复地排列。
非晶体是各向同性的。因为非晶体内部微粒的排列是无次序的、不规律的。晶体的宏观性质是由其微观结构决定的,要了解晶体的性质,就必须了解它的微观结构。
晶体中规则排列的微粒,抽象为几何学中的点,称为结点(crunode),这些结点的总和称为空间点阵(lattice)。沿着一定的方向按某种规则把结点连接起来,得到的描述各种晶体内部结构的几何图像,称为晶格(crystal lattice)。晶格中,表现其结构一切特征的最小部分,称为晶胞(unit cell)。晶胞的大小和形状可用六面体中经过同一顶点的三个棱长a、b、c和通过同一顶点的三个棱的夹角α、β、γ6个常数(参数)来描述,称为晶胞参数。晶胞参数可由X射线衍射法测得。晶胞在三维空间的无限重复就形成了晶格。
根据晶胞形状及晶胞参数的不同,可将晶体归结为7个晶系。表3-1列出了7个晶系的特征。7个晶系按照带心形式分类,可分为14种布拉维(Bravais)晶格,如图3-1和图3-2所示。
表3-1 7个晶系的特征

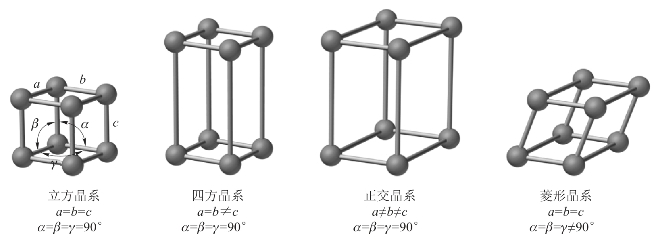
图3-1 7种晶系的结构

图3-1 7种晶系的结构(续)

图3-2 14种布拉维晶格
按照晶格结点上粒子种类及粒子之间结合力的不同,晶体可分为离子晶体(ionic crystal)、共价晶体(covalent crystal)、分子晶体(molecular crystal)和金属晶体(metallic crystal)。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




