原子半径可理解为原子核到最外层电子的平均距离。对于任何元素来说,原子总是以键合形式存在于单质或化合物中(稀有气体例外)。从量子力学观点考虑,原子在形成化学键时总是会发生一定程度的原子轨道重叠,因此,严格说来,原子半径有不确定的含义;而且要给出任何情况下均适用的原子半径是不可能的。通常所说的原子半径是指共价半径(covalent radii)、金属半径(metal radii)和范德华半径(Vander Waals radii),如图2-25所示。
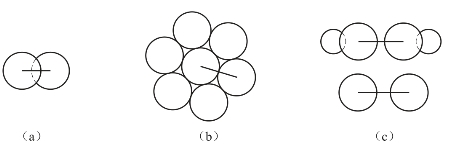
图2-25 原子半径
(a)共价半径;(b)金属半径;(c)范德华半径
同种元素的两个原子以共价单键结合时(如H2、Cl2等),它们核间距离的一半叫作原子的共价半径。如果把金属晶体看成是由球状的金属原子堆积而成,并假定相邻的两个原子彼此是互相接触的,则它们的核间距离的一半就是该原子的金属半径。在分子晶体中,两个分子之间是以范德华力(即分子间力)结合的,相邻分子间两个非键合原子核间距离的一半称为范德华半径。
由于原子之间形成共价键时,总是会发生原子轨道的重叠,所以原子的金属半径一般比共价半径要大些。例如,测得金属钠晶体中钠原子之间的核间距离d=372 pm,所以钠原子的金属半径r Na=d/2=186 pm;钠原子在形成气态双原子分子时的共价半径为154 pm。由于分子间作用力较小,分子间距离较大,因此范德华半径总是较大的。这就提示我们在比较原子半径大小时,应采用同一套数据。
在讨论原子半径的变化规律时,通常采用的是原子的共价半径,但稀有气体元素只能采用范德华半径。周期表中各元素的原子半径如图2-26所示。(https://www.xing528.com)

图2-26 元素的原子半径表(单位:pm)
原子半径的大小主要取决于原子的有效核电荷和核外电子的层数。周期表中的主族元素,从ⅠA族到ⅦA族,由于原子的核电荷数逐渐增加,电子层数保持不变,新增加的电子依次填充在同一电子层中。电子之间的相互排斥作用虽然增加,但因同层电子的排斥作用增加效果小于核电荷数增加的效果,因此,核对电子的吸引力增大,同一周期中,主族元素随着核电荷的增加原子半径逐渐变小。
过渡元素和内过渡元素原子半径的变化情况有所不同。过渡元素随着核电荷数的增加,原子核对外层电子的吸引增加缓慢,从而使原子半径的总体变化趋势是略有减小;当d轨道处于全充满时,原子半径要略大一些。对于电子最后填入f轨道的镧系和锕系元素,也有类似的情况。即总体趋势是原子半径随原子序数增加而减小,并在f轨道处于半充满、全充满时出现原子半径略有增大的情况。
由于镧系元素随着原子序数的增加,原子半径总体上减小,虽然相邻元素的原子半径减小幅度有限,但10多个元素的原子半径减小的累积效果,使其后的过渡元素的原子半径也因此而缩小,从而导致了第五周期过渡元素的原子半径与第六周期同族元素的原子半径非常接近,此现象称为镧系收缩(lanthanide contraction)。对同一族的过渡元素,因其价电子构型与原子半径都相似,使它们的化学、物理性质都基本一致。所以,这些元素呈现在自然界中的形式非常相似,并且分离困难。
在同一族中,自上而下,原子中的电子层数是逐渐增多的,其最外层电子的主量子数增大,离核平均距离也增大,因此,原子半径显著增大。其中主族元素的原子半径随周期数增大而增加的幅度较大;而副族元素的原子半径随周期而增加的趋势较小,尤其是第五周期和第六周期的同族元素,因镧系收缩的影响,原子半径非常接近。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




