原子轨道(atomic orbital)这个新概念不同于古典物理学中的轨道想法,1932年,美国化学家罗伯特·马·利肯(Robert Sanderson Mulliken,1896—1986)提出以“轨道(orbital)”取代“轨道(orbit)”一词。所以,讲玻尔轨道时,用orbit;量子力学中的原子轨道用orbital。原子轨道有不同的形状和空间取向,如图2-16所示。
电子在原子核外很小的空间内做高速运动,其运动规律跟一般物体不同,它没有明确的轨道。根据量子力学中的测不准原理(Heisenberg Uncertainty Principle),我们不可能同时准确地测定出电子在某一时刻所处的位置和运动速度,也不能描画出它的运动轨迹。电子的运动符合薛定谔方程,而薛定谔的解称为“波函数”,波函数就是原子轨道。波函数绝对值的平方表示电子在核外空间各处出现的概率密度。密度大的地方,表明电子在核外空间出现的概率大;反之,则表明电子出现的概率小。它代表核外空间某处电子出现的概率,即概率密度(probability density)。概率密度是指电子在核外空间某处微体积元内出现的概率,概率密度与该区域微体积元的乘积ψ2·dτ等于电子在核外某区域中出现的概率。若以小黑点的疏密程度表示核外空间各点概率密度的大小,则ψ2大的地方,小黑点较密集,表示电子出现的概率密度较大;ψ2小的地方,小黑点较稀疏,表示电子出现的概率密度较小。这种以小黑点的疏密表示概率密度分布的图形称为电子云(electron cloud)。因此,电子云就是从统计概念出发对核外电子出现的概率密度ψ2形象化的图示。
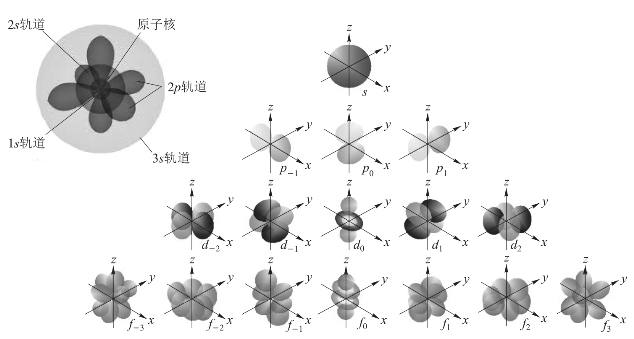
图2-16 原子轨道的形状和空间取向(https://www.xing528.com)
图2-17(a)所示为氢原子的1s电子云。图2-17(b)为电子在核外空间出现的概率密度。原子核附近处ψ2较大,而离原子核越远,ψ2就越小。从量子力学可以了解到,电子云是没有边界的,即使在离核很远的地方,电子仍有可能出现,只是出现的概率很小,可以忽略而已。
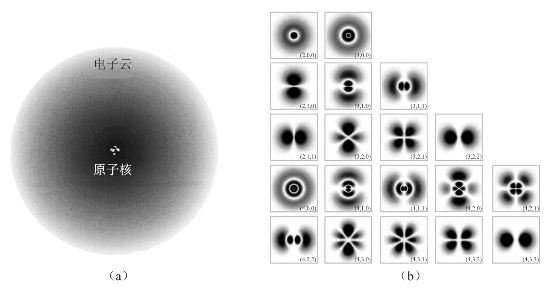
图2-17 波函数的解
(a)氢原子电子云;(b)核外电子概率密度的二维图
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




