原子是由电子、质子和中子组成的。那么它的结构又是怎样的呢?
1909年,卢瑟福在英国曼彻斯特大学和他的学生Johannes Geiger及Emest Marsden在做用α粒子轰击薄金箔时,发现大部分的α粒子都能通过金箔,但有1/8 000的粒子居然被反弹回来。他根据实验事实,提出了原子核模型(Nuclear Model),认为原子大部分空间是空的,所有正电荷和原子质量都集中在原子中心的一个非常小的体积内,即原子核;电子围绕原子核旋转。1911年3月,卢瑟福在曼彻斯特文学与哲学学会的会议上宣布他的意外发现。这就是著名的卢瑟福的金箔实验,如图2-7所示。
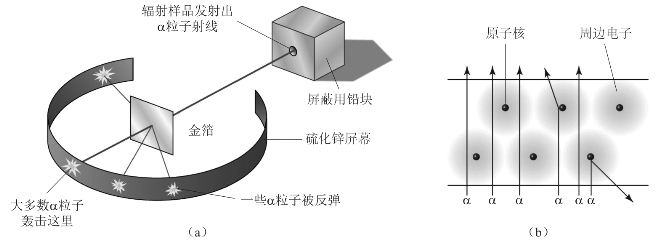
图2-7 卢瑟福的金箔实验示意图
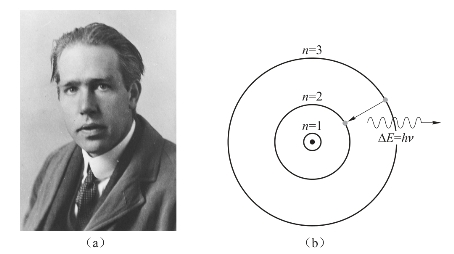
卢瑟福的原子核模型也存在无法解决的困难:因为绕核旋转的电子具有加速度,按照经典动力学,带点粒子加速运动会放出能量,这样,电子的轨道半径会越来越小,最后落在原子核上。而实际上,原子是稳定的。卢瑟福的学生,丹麦物理学家玻尔(Niels Henrik David Bohr,1885—1962)提出了太阳系模型,成功地解决了卢瑟福模型的困难,如图2-8所示。
 (https://www.xing528.com)
(https://www.xing528.com)
图2-8 玻尔半径的提出
(a)波尔;(b)太阳系模型
在普朗克和爱因斯坦的量子化概念以及里德伯实验公式的启发下,玻尔将量子概念应用于卢瑟福原子模型中,将原子结构和光谱联系起来,提出了玻尔模型(Bohr Model)。其基本思想是:氢原子中的一个电子绕核做圆周运动,电子只能处于一些分立的“允许轨道”(allowed orbits)上;每一个允许轨道对应一个确定的分立能级En;电子在这些确定的轨道上运动时不会损失能量;当电子从一个“允许轨道”跃迁到另一个“允许轨道”时,会以电磁波的形式放出或吸收能量,电磁波的频率由两个轨道的能级差来确定。
玻尔模型对于氢原子光谱的解释:氢原子光谱的产生是由于氢原子对外发射光能,这表明激发使原子中的电子从高能量轨道掉落入低能量轨道。玻尔第一个将量子概念用到原子有核模型中,成功地给出了氢原子结构的描述,揭开了令人费解的氢光谱之谜,对量子论和原子物理的发展做出了重大贡献。1922年,玻尔荣获诺贝尔物理学奖。
玻尔模型将经典力学的规律应用于微观的电子,不可避免地存在一系列困难。根据经典动力学,做加速运动的电子会辐射出电磁波,致使能量不断损失,而玻尔模型无法解释为什么处于定态的电子不发出电磁辐射。玻尔模型对跃迁的过程描述含糊。因此,玻尔模型提出后,遭到了包括卢瑟福、薛定谔在内的诸多物理学家的质疑。玻尔曾经的导师、剑桥大学的J.J.汤姆逊拒绝对其发表评论。此外,玻尔模型无法揭示氢原子光谱的强度和精细结构,也无法解释稍微复杂一些的氦原子的光谱,以及更复杂原子的光谱。因此,玻尔在领取1922年诺贝尔物理学奖时称:“这一理论还是十分初步的,许多基本问题还有待解决。”玻尔模型引入了量子化的条件,但它仍然是一个“半经典半量子”的模型。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




