早在2 000多年前,古希腊自然派哲学家德谟克利特(Democritus,公元前460年—公元前370年或公元前356年)(图2-1)就认为万物的本源是“原子”与虚空。原子是一种最后的不可分的物质微粒。宇宙的一切事物都是由在虚空中运动着的原子构成的。原子是不可再分的物质微粒,虚空是原子运动的场所。德谟克利特认为原子是最小的、不可分割的物质粒子。原子之间存在着虚空,无数原子从古以来就存在于虚空之中,既不能创生,也不能毁灭,它们在无限的虚空中运动着构成万物。当然,德谟克利特的原子论不是科学理论,而只是哲学推测。直到2 000年后的19世纪,才创建了科学原子论。
英国科学家道尔顿(John Dalton,1766—1844)(图2-2)是科学原子论的创始人。1803年12月与1804年1月,道尔顿在英国皇家学会作关于原子论的演讲中全面阐释了他的原子论思想:
所有物质都是由微小的、不可分割的、被称为“原子”的微粒所组成;原子既不能创生,也不能毁灭。
同一元素的所有原子,在所有性质上都相同;不同元素的原子,在性质上都不相同。
化学反应是原子按照简单整数比从一种组合到另一种组合的简单重排。

图2-1 德谟克利特

图2-2 道尔顿

图2-3 J.J.汤姆逊
在这里,道尔顿所说的原子已不再是哲学术语,而是实实在在的组成物质的基本单元。在此之前,道尔顿还根据实验观察,提出了“倍比定律”(Law of Multiple Proportions)[1]。道尔顿于1803年首次提出他观察到的这个现象。这对于他之后提出的原子论有深远的影响,并且奠定了后世使用化学式的基础。
1897年,英国剑桥大学卡文迪许实验室(Cavendish Laboratory)教授J.J.汤姆逊(J.J.Thomson,1856—1940)(图2-3)利用当时最先进的真空技术研究阴极射线,使阴极射线在电场中发生稳定的电偏转,从偏转方向证明阴极射线确为带负电粒子。他利用电场和磁场巧妙而精确地测量了阴极射线粒子的电荷与质量之比(charge to mass ration),简称“荷质比”。
通过进一步的实验,J.J.汤姆逊发现当改变阴极材料的种类或者改变阴极射线管内气体的种类时,测得的荷质比e/m保持不变。e/m值比电解质中氢离子的比值(这是当时已知的最大量)还要大得多。说明这种粒子的质量比氢原子的质量要小得多。J.J.汤姆逊认为这种粒子是各种材料中的普适成分(fundamental part of matter)。他冲破了道尔顿“原子不可分割”的束缚,认为这种粒子是原子的组成部分。J.J.汤姆逊采用1891年乔治·斯托尼(George Johnstone Stoney)所起的名字——电子(electron)来称呼这种粒子。电子是第一个被发现的微观粒子,电子的发现,对我们了解原子组成起了极为重要的作用,因为它是构成所有物质的普适成分。正由于电子的发现,J.J.汤姆逊被后人誉为“最先打开通向基本粒子物理学大门的伟人”。J.J.汤姆逊荣获了1906年诺贝尔物理学奖。(https://www.xing528.com)
随后,不少科学家不断努力,希望精确测量电子的电荷值,其中最有代表性的是美国科学家密立根(Robert Andrews Millikan,1868—1953)(图2-4(a)),他以严谨的科学态度和追求精确测量的精神受到了人们的称赞。密立根因而获得1923年的诺贝尔物理学奖。密立根油滴实验(Oil Drop Experiment)(图2-4(b))的目的是测量单一电子的电荷。实验方法主要是通过调节电压平衡重力与电力,使油滴悬浮于两片金属电极之间,并根据已知的电场强度,计算出整颗油滴的总电荷量。重复对许多油滴进行实验之后,密立根发现所有油滴的总电荷值皆为同一数字的倍数,因此,认定此数值为单一电子的电荷e,e为1.592×10-19 C。到2006年,已知基本电荷值为1.602 176 53×10-19 C。
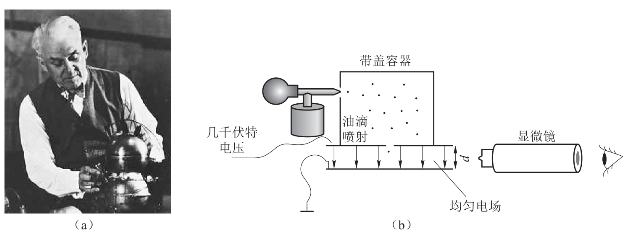
图2-4 密立根及其油滴实验
(a)密立根;(b)密立根油滴实验
J.J.汤姆逊发现电子后,人们马上想到电中性的原子很可能是由带负电的电子和带正电荷的部分所组成。1919年,J.J.汤姆逊的学生,英国剑桥大学卡文迪许实验室教授,新西兰著名物理学家,被称为核物理之父的卢瑟福(Ernest Rutherford,1871—1937)(图2-5)利用α粒子轰击氮原子,发现闪光探测器记录到氢核的迹象。卢瑟福认识到这些氢核唯一可能的来源是氮原子,因此氮原子必含有氢核。因此,卢瑟福建议原子序数为1的氢原子核是一个基本粒子,即质子(proton)。卢瑟福发现质子以后,又预言了不带电的中子(neutron)存在。
作为卢瑟福的学生,查德威克(James Chadwick,1891—1974)(图2-6)经过更仔细的实验研究,宣布发现了一种新的粒子——中子(neutron)。查德威克为此荣获了1935年诺贝尔物理学奖。

图2-5 卢瑟福
图2-6 查德威克中子的发现
(a)查德威克;(b)中子的发现
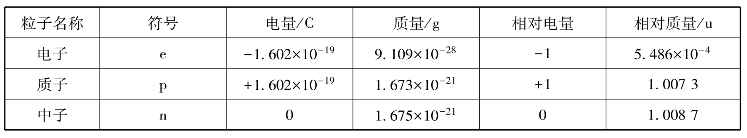
中子的发现具有划时代的意义,是原子核物理发展史上的一个里程碑。由于中子不带电,用它来轰击其他原子核时,不受静电作用,有更多机会与靶核碰撞,为原子核物理研究开辟了新的道路,也为后来核能的利用打下了基础,表2-1列出了原子的基本构成。
表2-1 原子的基本构成
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




