蒸馏是利用混合物中各组分沸点的不同来分离纯化液体混合物的有效方法。蒸馏主要有普通蒸馏、减压蒸馏、分子蒸馏、水蒸气蒸馏和分馏等。
1.普通蒸馏 蒸馏是指将液态物质加热至沸腾,使其成为蒸汽状态,再将其冷凝为液体的过程。常压蒸馏可以把挥发性液体与不挥发物质分开,也可以分离两种或两种以上沸点相差较大(至少30℃以上)的液体。
对于受热的液体混合物而言,在溶液的相平衡中,蒸汽的组成不同于液体的组成。图2-6是二组分系统(A+B)典型的蒸汽—液体关系相图。图中,上面的曲线代表蒸汽的组成;下面的曲线代表液体的组成;左边为纯A,沸点为tA;右边为纯B,沸点为tB。水平线代表一恒定温度。在同一温度下,液体与蒸汽组成不同,如t温度下,X代表组分为W的液体与组成为Z的蒸汽达成平衡。A和B的组成用其在混合物中的物质的量百分比表示。
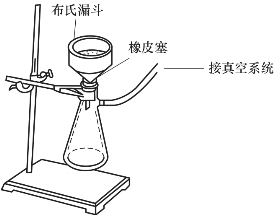
图2-5 减压过滤装置
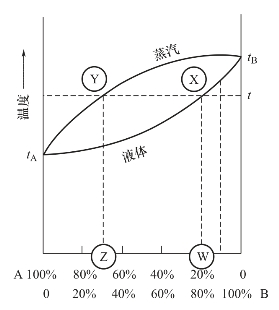
图2-6 典型的二组分液体混合物的相图
2.共沸蒸馏
(1)共沸蒸馏。一些混合物的蒸馏曲线如图2-7所示。A+B混合组分在一定温度条件下可形成共沸混合物,即与液体平衡的蒸汽组分与液体本身的组成相同。共沸混合物不能用常规的蒸馏方法将各组分分离。但可利用A+B混合组分共沸蒸馏的原理,除去被蒸馏掉的高沸点溶剂。如DMF、DMSO溶剂的去除,可采用加入苯或甲苯以蒸出高沸点溶剂,在溶液浓缩和蒸除方面的应用很有意义。
蒸馏装置如图2-8所示,由温度剂、蒸馏瓶、蒸馏头、冷凝管、接引管、接收瓶等组成。
(2)温度计。测温使用的温度计量程应高于溶液沸点10~20℃,但不宜高出太多。温度计量程越宽,精确度越差。温度计的位置要放在使其温度计汞球与蒸馏头侧支管在同一水平线上。
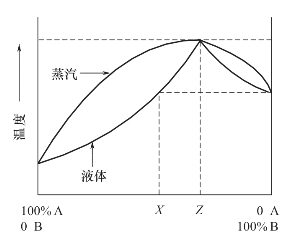
图2-7 最高沸点共沸物

图2-8 蒸馏装置
(3)蒸馏瓶。液体的加入量不应超过蒸馏瓶容积的2/3,以使蒸馏的面积足够大。蒸馏前,应在蒸馏瓶中放入少量沸石或其他类似物(毛细管),以防暴沸。
(4)冷凝管。蒸馏沸点小于150℃的物质时,选用直形冷凝管。直形冷凝管的长度取决于蒸馏液体的沸点。沸点越低,蒸汽不易冷凝,故选用长的冷凝管;沸点越高,蒸汽易冷凝,可选用短的冷凝管。当物质的沸点>150℃时,应可选用空气冷凝管,因为蒸汽温度较高,遇冷循环水有时会发生炸裂。
(5)加热浴。有机物蒸馏不能用明火加热。一般选用电热套或加热浴。低温(<85℃)加热时可选用水浴加热;85~200℃时,可选用油浴;>200℃时选用硅油浴、电热套等。
(6)蒸馏速度。一般情况下,每秒1滴的蒸出速度是合适的。待蒸馏物质不能全部蒸干,应留少许,以防加热过度造成意外。
蒸馏完毕,先停火,再停止通冷凝水,最后拆卸仪器。
3.减压蒸馏 高沸点的化合物蒸馏时,常由于强烈的加热而使化合物发生分解或沸点太高难以蒸馏,这时可采用减压蒸馏,以降低沸点,减少物质的分解,增加蒸馏效果。
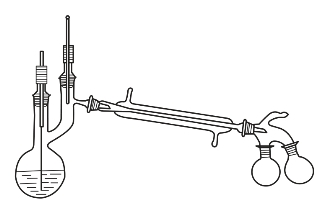
图2-9 减压蒸馏装置图
减压蒸馏是依据液体表面分子溢出所需的能量随外界压力的降低而降低的原理,因此降低压力可降低液体的沸点。
减压蒸馏的装置如图2-9所示。减压蒸馏装置包括蒸馏烧瓶、Claisen蒸馏头(克氏蒸馏头)、起泡管、冷凝管、接收瓶等蒸馏装置和减压装置等,如图2-9所示。
(1)起泡管。减压蒸馏时,需采用一种方法生成小气泡,以防暴沸。管用的沸石在真空中不起作用。虽然有时也用微孔沸石防止暴沸,但在多数真空条件下用起泡管。起泡管穿过塞子插入液下,上部通过螺旋夹控制进入的空气量。如果所分离物质易氧化,上端可通氮气保护。
(2)蒸馏瓶。液体量不超过瓶体积的1/3~1/2。
(3)克氏蒸馏头。一个插起泡管,一个插温度计。克氏管可在暴沸时防止液体被带出。
(4)蒸馏管。多数情况下选用直形冷凝管,高沸点的液体选用空气冷凝管。
(5)多头接引管。采用多头接引管,通过转动,可以随时接引不同的组分,很方便。
(6)真空装置。根据所分离液体的沸点,选用不同真空度大小的真空泵。真空度越高,操作越麻烦,能用水泵则不用油泵。
4.水蒸气蒸馏 水蒸气蒸馏法是指将含有挥发性成分的物质与水共蒸馏,使挥发性成分随水蒸气一并蒸馏出,再经冷凝分取挥发性成分的方法。该法适用于具有挥发性、能随水蒸气蒸馏而不被破坏、在水中稳定且难溶或不溶于水的药材成分的浸提。
水蒸气蒸馏对被分离有机化合物的要求是:不溶或微溶于水;可长时间与水共沸,不与水反应;近100℃时有一定的蒸汽压,一般不少于1.33Pa(10mmHg)。
水蒸气蒸馏是从动植物中提取芳香油(挥发油)、提取含挥发性成分药材等天然产物最常用的方法之一。
(1)水蒸气蒸馏原理。在水蒸气蒸馏时,总的蒸汽压等于水的蒸汽压与组分的蒸汽压之和,即P总=P水+PS(组分分压)。即水蒸气蒸馏时,混合物沸腾的温度要低于水的正常沸点(P总>P水)。如水的沸点为100℃,甲苯为111℃,当两者混合在一起进行水蒸气蒸馏时,沸腾温度为84.6℃,在此温度下水的蒸汽压为56.39kPa(424mmHg),甲苯为44.69kPa(336mmHg),两者之和等于0.1MPa(760mmHg),即当时的大气压。
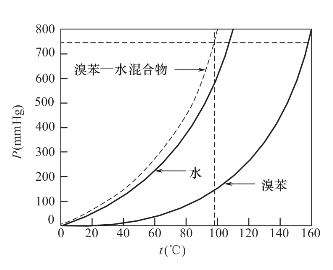
图2-10 溴苯、水、溴苯—水混合物的蒸汽压与温度关系
图2-10表示水(沸点100℃)和溴苯(沸点156℃)两种不互溶混合物以及两种化合物的混合蒸汽压对温度关系的坐标。图中虚线表示混合物应在95℃左右沸腾,该温度的总蒸汽压等于大气压。根据上述原理,该沸点温度要低于水的沸点,而在这种混合物中,水是最低沸点组分。因此,要在100℃或更低温度蒸馏化合物,水蒸气蒸馏是有效的。
馏出液中被提纯物与水的质量之比根据下式计算:
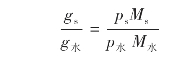
式中:p——液体的蒸汽分压;
g——气相下该组分的质量;
M——组分的相对分子质量。
(2)水蒸气蒸馏分类。实验室中进行的水蒸气蒸馏可分为两种:活蒸汽法和直接法。活蒸汽法是指从蒸汽管道中引入“活”的蒸汽,通入盛有有机化合物的烧瓶;直接法是将盛有化合物和水的烧瓶一起加热,直接进行水蒸气蒸馏。
①活蒸汽法。活蒸汽法应用广泛,尤其适用于高分子量(低蒸汽压)的物质,此法还可用于挥发性固体的水蒸气蒸馏。(https://www.xing528.com)
活蒸汽法水蒸气蒸馏的装置由蒸汽发生器和蒸馏装置两部分组成,如图2-11所示。这两部分连接处应尽可能紧凑,以防蒸汽通过较长管道后部分冷凝。在管道与蒸馏瓶之间接上气液分离装置或装上一个T形管以除去其中的冷凝水,即在T形管下端连一个弹簧夹,以便及时除去冷凝下来的水滴。
活蒸汽法水蒸气蒸馏的操作方法:在水蒸气发生器中加入2/3容积的蒸馏水,将蒸馏物倒入圆底烧瓶,用量不得超过烧瓶容积的1/3。检查装置是否漏气;开始蒸馏前,先将螺旋夹打开,加热水蒸气发生器至水沸腾。当T形管的支管有水蒸气冲出时,把夹子夹紧,使水蒸气均匀地通入圆底烧瓶中,这时烧瓶内的混合物翻滚不息,有机物和水的混合物蒸汽经过冷凝管冷凝成乳浊液进入接收瓶,控制馏出速度为2~3滴/s。当被蒸物质全部蒸出后,蒸出液变澄清,此时不要结束蒸馏,要再多蒸出10~20ml的透明馏出液方可停止蒸馏。
②直接法。直接法主要用于无固体存在的混合物蒸馏,该法简单,非常适于实验室操作。直接法水蒸气蒸馏装置如图2-12所示,即将盛有一定量水的分液漏斗置于克氏蒸馏头上,蒸馏瓶置于热源上,其他同活蒸汽法蒸馏装置。

图2-11 活蒸汽法水蒸气蒸馏装置
1—安全管 2—T形管 3—铜制水蒸气发生器 4—冷凝管
5.分馏 简单蒸馏可以分离两种或两种以上沸点相差较大的液体混合物。分馏可以分离两种或两种以上沸点相差较小或沸点接近的液体混合物。目前最精密的分馏设备已能将沸点相差1~2℃的混合物分离。
(1)分馏原理。如果将几种沸点不同又完全互溶的液体混合物加热,当其总蒸汽压等于外界压力时开始沸腾汽化。蒸汽中易挥发组分所占的比例比原液相中所占的比例要大。若将该气体凝结成液体,其中有较多的低沸点组分,根据这一现象可以把液体混合物中的各组分分离开。
图2-13是大气压下的苯—甲苯体系的沸点组成曲线图。苯和甲苯的沸点分别是80.10℃和110.63℃。从图中可以看出,苯20%和甲苯80%组成的液体(L1)在102℃时沸腾,与此液相平衡的蒸汽(V1)组成约为:苯40%和甲苯60%。若将此组成的蒸汽冷凝成同组成的液体(L2),则与此液相平衡的蒸汽(V2)组成约为:苯70%和甲苯30%。如此多次重复,即可获得接近纯苯的气相。

图2-12 直接法水蒸气蒸馏装置
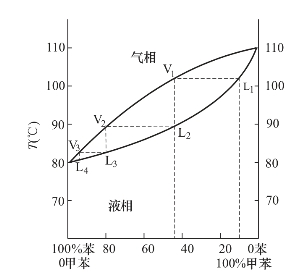
图2-13 苯—甲苯体系的沸点组成图
分馏柱分馏的原理是将被蒸馏的混合液体在蒸馏烧瓶中沸腾后,蒸汽进入分馏柱,在分馏过程中部分冷凝成液体。这些液体由于所含的低沸点成分较多,因此沸点也较烧瓶中的液体低。当烧瓶中的另一部分蒸汽上升至分馏柱中时,便和已冷凝的液体进行热交换,使它重新沸腾,而蒸汽自身则部分冷凝,这就又产生了一个新的液体和蒸汽的平衡。这样,由于上升蒸汽不断地在分馏柱内凝结和蒸发,而每一次的凝结和蒸发便将低沸点的成分提高一步。如选择适当的分馏柱,则在分馏柱上部出来的蒸汽经冷凝后流出的则是纯的低沸点馏出物。
(2)分馏柱的种类。实验室常用的分馏柱有维氏分馏柱和填充柱氏分馏柱两种,如图2-14所示。
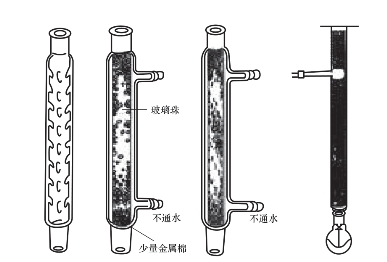
图2-14 分馏柱
维氏分馏柱:在分流少量液体时,经常使用一种柱内有许多“锯齿”的分馏柱,这些“锯齿”向下倾斜45°角,有利于气液的分布,高度10~60cm不等。其优点是结构简单、黏附的液体较填充柱少,且易装易洗。缺点是较同样长度的填充柱效率低。
填充柱式管状分馏柱:管直径2.5~3.5cm,管长30~60cm。分馏效率主要取决于填料的种类。
(3)分馏装置。分馏装置由蒸馏部分、冷凝部分与接收部分组成。蒸馏部分包括蒸馏烧瓶、分馏柱、分馏头,冷凝与接收部分与简单蒸馏一样。简单的分馏装置如图2-15所示。
(4)分馏操作。
①将待分馏的混合物加入圆底烧瓶中,加入数粒沸石。
②采用适宜的热浴加热,烧瓶内的液体沸腾后要注意调节浴温,使蒸汽慢慢上升,并升至柱顶。
③在开始有馏出液滴出后,记下时间与温度,调节浴温使蒸出液体的速率控制在每2~3s流出1滴。
④待低沸点组分蒸完后,更换接收瓶,此时温度可能回落。逐渐升高温度,直至温度稳定。此时所得的馏分称为中间馏分。
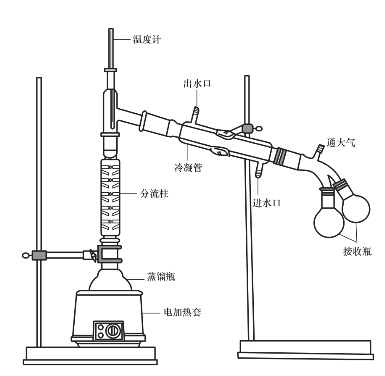
图2-15 分馏装置
⑤再换第3个接收瓶,在第2个组分蒸出时有大量馏出液蒸馏出来,温度已恒定,直至大部分被蒸出后,柱温又会下降。
⑥注意不要蒸干,以免发生危险。
6.分子蒸馏 分子蒸馏是一种特殊的液—液分离技术。它不同于传统蒸馏依靠沸点差进行分离,而是依靠不同物质分子运动平均自由程的差别实现分离。
分子的重凝聚需要分子间的碰撞,从而使它们转回液面。如果这种碰撞能够避免,分子就可按照直线方向行进,直至它们离开液面。表2-3显示的是空气分子的平均自由程(一分子与另一分子遭遇前所行经的平均距离)与系统压力之间的关系。由表中可见,压力越小,平均自由程越大,即分子间碰撞的机会越少。如系统的真空度能达到0.133Pa(10-3mmHg),则分子的平均自由程就可达到5.6cm以上。同时使冷凝面非常接近于液面,并使液体热表面与冷凝面的温差在100℃以上,就可以不产生重凝聚而只是蒸发,从而达到分子蒸馏的目的。
表2-3 空气自由程与压力的关系
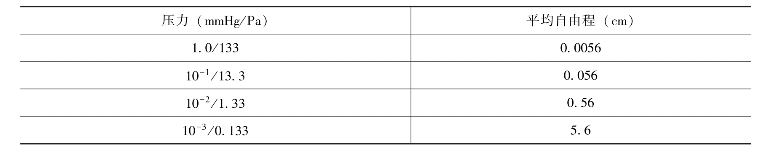
图2-16所示的是一种简单的分子蒸馏器。盛放液体的容器底部用油浴加热,接收器中放4根小管,可以转动接收4种馏分。真空度达到0.133Pa(10-3mmHg)以上,即可按真空蒸馏方法操作。
当液体混合物沿加热板流动并被加热,轻、重分子会逸出液面而进入气相,由于轻、重分子的自由程不同,因此不同物质的分子从液面逸出后移动距离不同。若能恰当地设置一块冷凝板,则轻分子达到冷凝板被冷凝排出,而重分子达不到冷凝板沿混合液排出,这样可达到物质分离的目的。在沸腾的薄膜和冷凝面之间的压差是蒸汽流向的驱动力,对于微小的压力降就会引起蒸汽的流动。
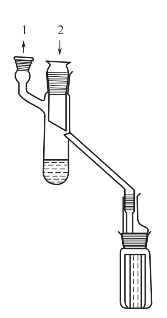
图2-16 分子蒸馏器
1.液—液萃取
(1)液—液萃取原理。该法是利用物质在互不相溶的两相溶剂中溶解度或分配系数的不同,而使物质从一种溶液转移至另一种溶液中,经反复多次萃取,将物质提纯分离出来。
此外,还可利用萃取剂与被萃取物质发生化学反应来得到分离。例如,碱性萃取剂可以从有机相中移出有机酸,或从有机溶剂中除去酸性物质;反之,酸性萃取剂可以从混合物中萃取碱性物质。这又称为洗涤。
(2)萃取方法。
①萃取一般在分液漏斗中进行。使用分液漏斗前,需在其下部活塞上涂凡士林,然后把分液漏斗放入水中摇荡,检查两个塞子处是否漏水。确认不漏时再使用。

图2-17 使用分液漏斗萃取
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




