【情境导入】
不同的金属材料具有不同的力学性能,即使是同一种金属材料,在不同的条件下其性能也是不同的。金属性能的这些差异从本质上来说,是由其内部结构所决定的。内部结构是指组成材料的原子种类和数量,以及它们的排列方式和空间分布。金属晶体结构包含哪些?它们又有哪些特点?
【讲一讲】
一、晶体与非晶体
固态物质按其原子(或分子)的聚集状态是否有序,可分为晶体与非晶体两大类。在物质内部,凡原子(或分子)在三维空间呈有序、有规则排列的物质称为晶体。自然界中绝大多数固体都是晶体,如常用的金属材料、水晶、氯化钠等;凡原子(离子或分子)在三维空间呈无序堆积状况的物质称为非晶体,如普通玻璃、松香、石蜡等。非晶体的结构状态与液体结构相似,故非晶体也被称为冻结的液体。
由于晶体内部的原子(或分子)排列具有规律性,所以,自然界中的许多晶体往往具有规则的几何外形,如结晶盐、水晶、天然金刚石等。晶体的几何形状与晶体的形成条件有关,如果条件不具备,其几何形状也可能是不规则的。故晶体与非晶体的根本区别不是几何外形规则与否,而是其内部原子排列是否规则。晶体与非晶体的区别除了几何形状是否规则外,还表现在以下方面:
①非晶体没有固定的熔点,加热时随温度的升高会逐渐变软,最终变为有明显流动性的液体;冷却时液体逐渐变稠,最终变为固体。而晶体有固定的熔点,当加热温度升高到某一温度时,固态晶体转变为液态。例如,纯铁的熔点为1 538℃,铜的熔点为1 083℃,铝的熔点为660℃。
②非晶体由于原子排列无规则,在各个方向上的原子聚集密度大致相同,故在性能上表现为各向同性。而晶体在不同的方向上具有不同的性能,即晶体表现出各向异性。
晶体与非晶体在一定条件下可以相互转换,如玻璃经高温长时间加热后能形成晶态玻璃。而通常呈晶态的物质从液态快速冷却时也可能转变为非晶体,如金属液体在冷却速度超过107℃/s时,可得到非晶态金属。晶体可分为金属晶体和非金属晶体两大类。金属晶体除了具有晶体所共有的特征外,还具有一些独特的性能,如具有金属光泽、导电性、导热性和延展性等。
1.晶格和晶胞
在金属晶体中,原子是按一定的几何规律呈周期性有规则排列的,不同晶体的原子排列规律不同。为了便于研究,人们把金属晶体中的原子近似看作一个个刚性小球,则金属晶体就是由这些刚性小球按一定几何规则紧密排列而成的物体,如图6-1所示。这种图形不便于分析晶体中原子的空间位置,为了便于研究晶体中原子的排列情况,可将刚性小球再简化成一个点,用假想的线将这些点连接起来,构成有明显规律性的空间格架。这种表示原子在晶体中排列规律的空间格架称为晶格,如图6-2(a)所示。晶格由许多形状、大小相同的几何单元在三维空间重复堆积而成。为了便于讨论,通常从晶格中选取一个能完全反映晶格特征的最小几何单元来分析晶体中原子排列的规律,最小几何单元称为晶胞,如图6-2(b)所示。
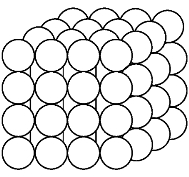
图6-1 晶体内部原子排列示意图
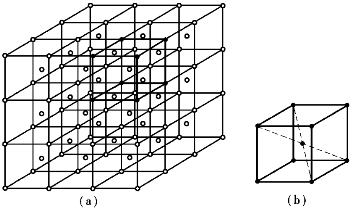
图6-2 晶体和晶胞示意图
(a)晶格;(b)晶胞
2.晶格常数
不同元素的原子半径大小不同,在组成晶胞后,晶胞大小也不相同。在金属学中,通常取晶胞角上某一结点作为坐标原点,沿其3条棱边作为坐标轴x、y、z,称为晶轴。规定在坐标原点的前、右、上方为坐标轴的正方向,并以棱边长度a、b、c分别作为坐标轴的长度单位,如图6-3所示。晶胞的大小和形状完全可以由3个棱边长度和3个晶轴之间的夹角来表示。晶胞的棱边长度称为晶格常数,对于立方晶格来说,晶胞的3个方向上的棱边长度都相等(a=b=c),用一个晶格常数α表示即可。晶格常数的单位为A°(埃,lA°=10-10m)。3个晶轴之间的夹角也相等,即α=β=γ=90°。

图6-3 简单立方晶格的晶胞表示方法
3.晶面和晶向
在晶体中由一系列原子中心所构成的平面称为晶面。图6-4所示为简单立方晶格的一些晶面。通过两个或两个以上原子中心的直线可代表晶格空间排列的一定方向,称为晶向,如图6-5所示。由于晶体中不同晶面和晶向上原子排列的疏密程度不同,因此原子之间的结合力大小也就不同,从而在不同的晶面和晶向上显示出不同的性能,即晶体的各向异性,这是晶体区别于非晶体的重要标志之一。晶体的这种特性不仅表现在力学性能上,还表现在物理性能和化学性能上,并在工业生产中有着一定的应用。
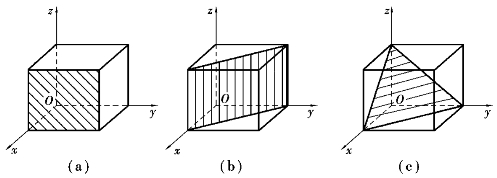
图6-4 简单立方晶格中的晶面
二、金属晶格的类型
在自然界存在的金属元素中,除了少数金属具有复杂的晶体结构外,绝大多数金属(占85%以上)都具有比较简单的晶体结构。最常见的金属晶体结构有3种类型,即体心立方晶格、面心立方晶格、密排六方晶格。
1.体心立方晶格(https://www.xing528.com)
体心立方晶格的晶胞是一个立方体(a=b=c,α=β=γ=90°),其原子位于立方体的8个顶角上和立方体的中心,如图6-6所示。由于晶胞角上的原子同时为相邻的8个晶胞所共有,而立方体中心的原子为该晶胞所独有,所以,每个体心立方晶格晶胞中实际含有的原子数为1个+8个/8 =2个。具有体心立方晶格的金属有α-铁(α-Fe)、铬(Cr)、钒(V)、钨(W)、钼(Mo)等金属。
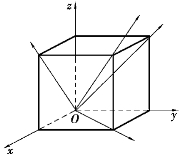
图6-5 简单立方晶格中的晶向
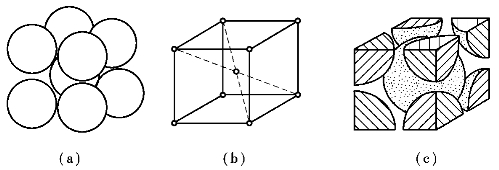
图6-6 体心立方晶胞
2.面心立方晶格
面心立方晶格的晶胞也是一个立方体,其原子位于立方体的8个顶角上和立方体的6个面的中心,如图6-7所示。由于晶胞角上的原子同时为相邻的8个晶胞所共有,而每个面中心的原子为两个晶胞所共有,所以,每个面心立方晶格晶胞中实际含有的原子数为8个/8+6个/2=4个。具有面心立方晶格的金属有γ-铁(γ-Fe)、铝(Al)、铜(Cu)、铅(Pb)、镍(Ni)、金(Au)、银(Ag)等金属。
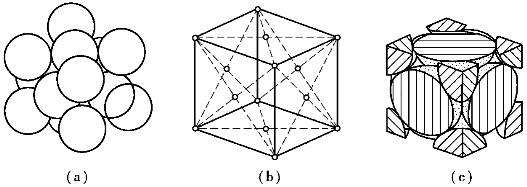
图6-7 面心立方晶胞
3.密排六方晶格
密排六方晶格的晶胞是一个正六棱柱体,原子排列在柱体的每个顶角上和上、下底面的中心,另外3个原子排列在柱体内,如图6-8所示。晶格常数用正六边形底面的边长α和晶胞高度c表示,两者的比值c/a=1.633,此时,上下两底面的原子与柱体内的3个原子紧密接触,是真正的密排六方结构。由于晶胞角上的原子为6个晶胞所共有,上下底面中心的原子为2个晶胞所共有,而柱体内的3个原子为该晶胞所独有,故每个密排六方晶格晶胞中实际含有的原子数为12个/6+2个/2+3个=6个。具有密排六方晶格的金属有镁(Mg)、锌(Zn)、铍(Be)、镉(Cd)等。
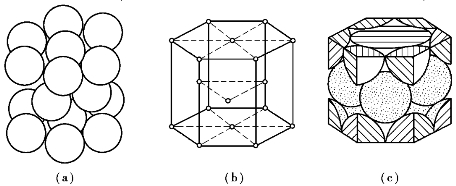
图6-8 密排六方晶胞
以上3种晶格由于原子排列规律不同,它们的性能也不同。一般来说,具有体心立方晶格的金属材料,其强度较高而塑性相对较差一些;具有面心立方晶格的金属材料,其强度较低而塑性很好;具有密排六方晶格的金属材料,其强度和塑性均较差。当同一种金属的晶格类型发生改变时,金属的性能也会随之发生改变。
【议一议】
活动一:分组讨论晶体与非晶体的区别。
活动二:分组讨论列举3种晶格的代表金属。
【做一做】
简答题
1.列举3种金属并分析其晶体结构。
2.分析3种晶格金属性能有哪些差别?
【评一评】
试用量化方式(评星)评价本节学习情况,并提出意见与建议。
学生自评:______________________________
小组互评:______________________________
老师点评:______________________________
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




