1.氨水溶液的温度-质量分数图
图1-35为在一定压力下氨水溶液的温度-质量分数(t-ξ)图。纵坐标为温度t,横坐标为氨的质量分数ξ。氨水溶液是由两种易挥发性物质所组成,因此在蒸汽中也有两种组分。由于氨比水更易挥发(在相同压力下,氨的沸点低于水),因此在气相中氨的质量分数将大于液相中的质量分数。曲线ABC表示饱和蒸汽的温度与质量分数的关系,曲线ADC表示饱和液体与质量分数之间的关系。前者称为凝结曲线,后者称为沸腾曲线。沸腾曲线以下为未饱和液体区域(也叫过冷区域)。在曲线ABCDA以内为湿蒸汽区域,即液体和蒸汽共存的区域。
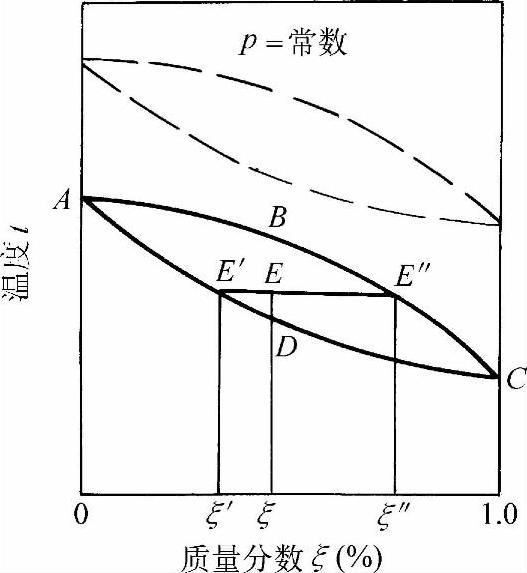
图1-35 氨水溶液的温度-质量分数图
在两相区域内,任一点E的组成可按杠杆规则来确定,如以m1代表饱和液体质量,m2代表饱和蒸汽质量,则

状态点E表示具有质量为m1、状态为E′、质量分数为ξ′的饱和液体,与具有质量为m2、状态为E″、质量分数为ξ″的饱和蒸汽所组成的湿蒸汽。
氨水溶液是由两种沸点不同的液体组成,其中氨的沸点较低,因此在饱和蒸汽(点E″)中,氨的质量分数ξ″比处于平衡态的饱和液体(点E′)的质量分数ξ′要大,即ξ″>ξ′。
图1-35中实线表示在一定压力p下的温度-质量分数(t-ξ)图。如果在不同压力下,则可用另外两线表示。当压力p升高时,则凝结和沸腾曲线如图中虚线所示。
氨水溶液在等压下沸腾时,由于蒸发出来的蒸汽中氨的质量分数大,因此,剩下的溶液中氨的质量分数就下降,显然溶液沸腾温度将升高,即在等压蒸发时,必然伴随着沸腾温度的升高。
2.溴化锂水溶液的温度-质量分数图
图1-36表示在一定压力p下溴化锂水溶液的温度-质量分数(t-ξ)图。纵坐标为温度t,横坐标为溴化锂的质量分数ξ。由于溴化锂的沸点高达1265℃,与溶剂水的沸点相差极大,因此溴化锂水溶液在一般温度下沸腾时,不会产生溴化锂蒸汽,而溶液面上部空间,可以认为全部都是水蒸气。在溴化锂水溶液的t-ξ图上,仅需画出等压饱和液体线,而饱和蒸汽线与纵坐标轴相重合(溴化锂的质量分数ξ=0)。
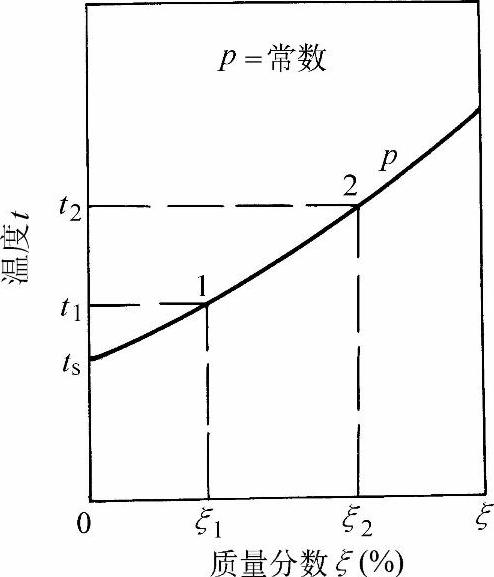
图1-36 溴化锂水溶液的温度-质量分数图(https://www.xing528.com)
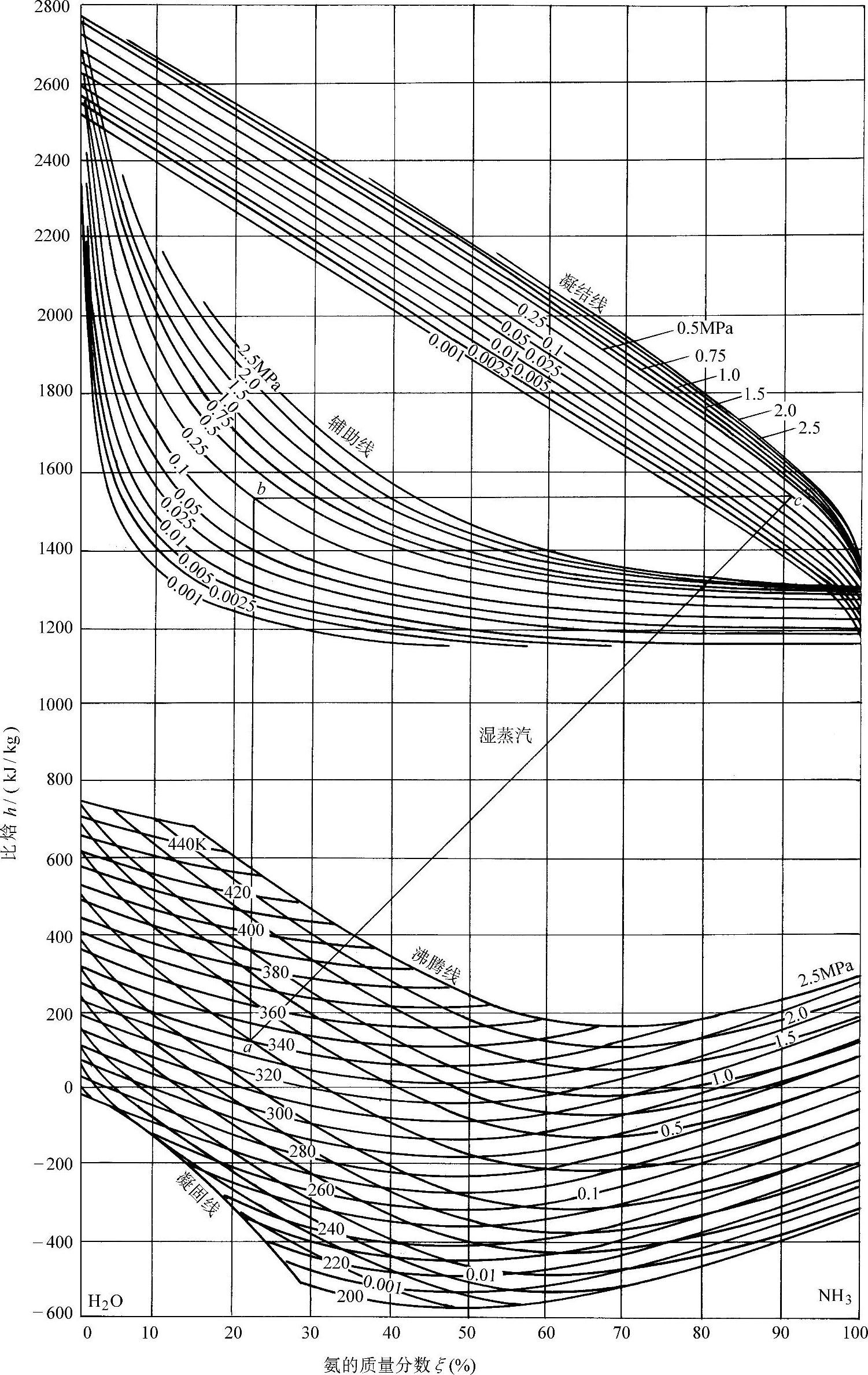
图1-37 氨水溶液的h-ξ图
由图1-36可知,当溶液的压力为p时,水蒸气的饱和温度为ts(与纯水相同);当溴化锂的质量分数分别为ξ1和ξ2时,其饱和温度分别为t1和t2,均高于纯水饱和温度ts。因此,溴化锂水溶液在沸腾过程中产生的是过热蒸汽,其过热度随溴化锂质量分数的增大而增加。
3.氨水溶液的焓-质量分数图
二元溶液的焓-质量分数(h-ξ)图是分析和计算吸收式制冷循环时常用的线图。利用此图,可以把吸收式制冷循环过程状态描述出来,同时可确定循环过程中各状态点的参数值。图1-37为氨水溶液的h-ξ图。图中水平线代表h为常数的等焓线,垂直线代表ξ为常数的氨质量分数线。h-ξ图的底部是一组不同压力下的液体沸腾线和一组等温线。在h-ξ图的上部为一组不同压力下的饱和蒸汽凝结线。在h-ξ图中间,还有一组不同压力的辅助线。
通过中间的辅助线,可绘出等压下由沸腾线到凝结线之间汽化过程的等温线。如p=0.25MPa及ξ′=0.22的饱和液体(图中点a所示),此时饱和液体的沸腾温度为340K(溶液的沸腾温度)。利用辅助线,从点a向上作垂直线,与0.25MPa辅助线相交得点b。再从点b向右作水平线,与压力为0.25MPa的凝结线相交得点c,连接点a及c,则直线a—c就表示湿蒸汽区域中温度为340K的等温线,此时溶液中液相的质量分数ξ′=0.22,气相的质量分数ξ″=0.91。
4.溴化锂水溶液的焓-质量分数图
由于溴化锂水溶液在一般温度条件下沸腾时,不会产生溴化锂蒸汽,因此溶液面上部空间可以认为全部都是水蒸气,所以它的h-ξ图与氨水溶液的h-ξ图是不同的。
图1-38为溴化锂水溶液的h-ξ示意图。该图分为两部分:下部为饱和溶液线;上部为与溶液相平衡的水蒸气压力辅助线。如溴化锂水溶液为压力p2、饱和温度为t2的状态点2,则其饱和溶液的质量分数为ξ2,比焓为h2。等压线p2与纵坐标轴相交的点1为p2压力下的饱和水蒸气状态点(此处溴化锂质量分数ξ=0),其饱和温度为t1,比焓为h1。
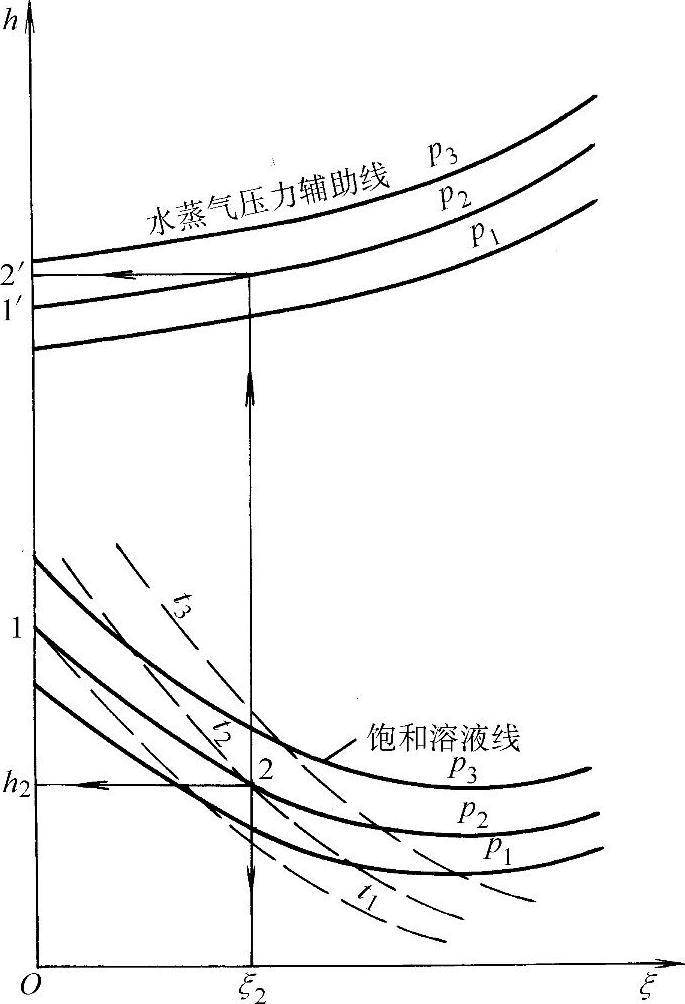
图1-38 溴化锂水溶液的h-ξ示意图
从点2向上作垂线,与水蒸气压力辅助线p2相交。从交点作水平线,与纵坐标相交得2′。该点表示饱和溶液面上压力为p2、温度为t2的过热水蒸气(因为t2>t1),其比焓为h′2,ξ=0。水蒸气压力辅助线p2与纵坐标的交点1′表示压力为p2、温度为t1的饱和水蒸气状态,其比焓值为h′1,ξ=0。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




