在吸收式制冷系统中,通常用两种不同挥发性物质组成的二元溶液工质。如吸收式制冷循环中的氨水溶液或溴化锂水溶液,均属于二元溶液。
二元溶液与纯物质之间存在着很大差别。纯物质各相的成分始终相同,在相变过程中,例如汽化过程,压力和温度始终保持不变,即ts=f(ps)。二元溶液就不一样了,不仅处于平衡的液相和气相成分不一样,而且在相变时,如定压下的汽化过程,温度也不能保持恒定,而是不断升高。
1.质量分数和摩尔分数
一种组分的质量与溶液质量之比称为这种组分的质量分数。当溶液仅由组分1和组分2所组成时,则组分1的质量分数ξ1为
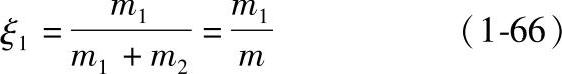
式中 m1、m2、m——溶液中组分1、组分2及溶液的质量。
显然,组分2的质量分数ξ2为
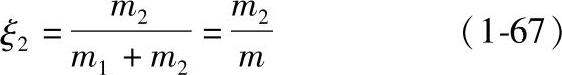
因此 ξ1+ξ2=1 (1-68)
如组分1的相对分子质量为M1,组分2的相对分子质量为M2,则组分1及组分2的摩尔数分别为
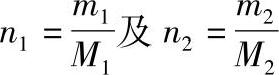
溶液的摩尔数为
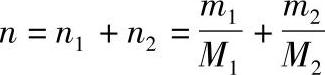
由此得组分1及组分2的摩尔分数x1及x2分别为因此
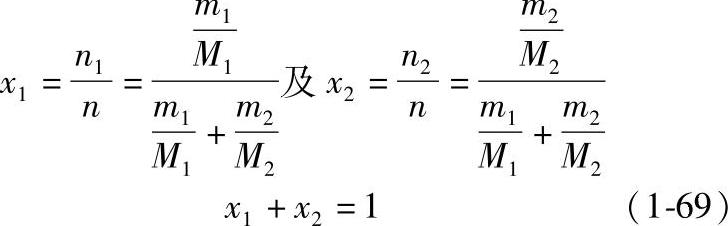
2.理想溶液
在一定温度和压力下,溶液中任何一种物质在任何质量分数下,均遵守拉乌尔定律的溶液,称为理想溶液。理想溶液的各种组分,在量上无论按什么比例,均能彼此均匀相溶;溶液中各种物质分子之间的相互吸引力完全相同,即溶剂分子之间、溶质分子之间及溶剂与溶质分子之间的相互吸引力完全相同;两种溶体相溶时无热效应;在相溶过程中容积无变化。
与理想气体相似,理想溶液也是一个极限概念,只有将溶液的质量分数尽量减小(即溶质的含量极少),成为稀溶液时,其性质才接近理想溶液。
3.拉乌尔定律(https://www.xing528.com)
拉乌尔定律说明,理想溶液中组分i的蒸汽分压力等于在溶液相同温度下,纯物质i的饱和蒸汽压和组分i的摩尔分数的乘积。其数学表达式为

式中 pi——组分i的蒸汽分压力(Pa);
p0i——在溶液相同温度下,组分i单独存在时的饱和蒸汽压力(Pa);
xi——组分i在溶液中的摩尔分数。
根据拉乌尔定律,对由物质A和物质B所组成的二元溶液,可得
pA=p0AxA及pB=p0BxB
则二元溶液的总压力为
p=pA+pB=p0AxA+p0BxB
因为xA=1-xB,所以上式可写成
p=p0A+(p0B-p0A)xB (1-71)
式(1-71)为一直线方程,如图1-33所示。如果两种液体混合成一理想溶液,则溶液的总蒸汽压力在两纯液体的饱和蒸汽压力之间。图1-33也称为压力-摩尔分数图。
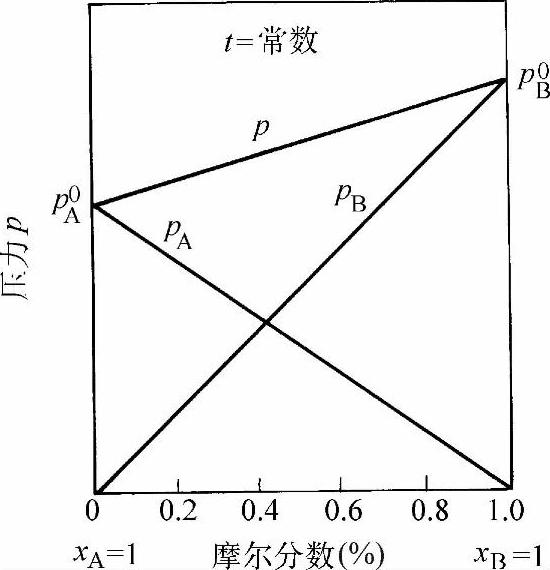
图1-33 理想溶液中蒸汽总压力和分压力的关系
图1-34表示溶液摩尔分数与蒸汽摩尔分数之间的关系。由于易挥发的组分B在蒸汽中的摩尔分数,一定大于溶液中的摩尔分数,所以蒸汽摩尔分数曲线(虚线)一定在溶液摩尔分数直线的下面。例如:当溶液的摩尔分数为x′B时,溶液中总蒸汽压力点C所对应的蒸汽点D的摩尔分数为x″B,显然x″B>x′B。
应该指出:大多数溶液不具有理想溶液的性质,实际溶液中各组分的蒸汽分压力在应用拉乌尔定律时,将产生偏差。但理想溶液的概念不仅在理论上有价值,而且也有实际意义,只要对理想溶液的公式作必要的修正,就能应用于实际溶液中。
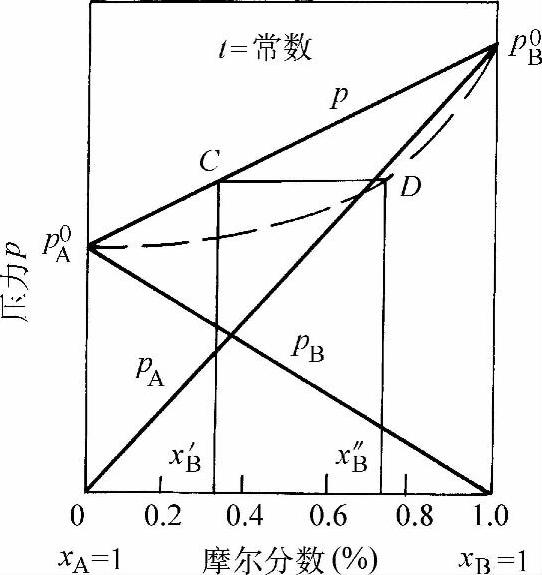
图1-34 溶液与蒸汽摩尔分数的关系
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




