1.热力学第二定律
热力学第一定律确定了热能传递、热能与机械能相互转换过程中的数量守恒关系。但人类通过长期的实践发现,并不是任何不违反热力学第一定律的过程都是可以实现的。因为自然界的一切过程都具有方向性,而热力学第二定律则阐述了自发过程进行的方向性和它的不可逆性,以及研究非自发过程必须具备的补充条件。
热力学第二定律有多种表述方式,但归纳起来主要有以下两种。
(1)克劳休斯表述法 热量不可能自发地、不付代价地从低温物体传到高温物体。它阐述了热量传递方向,即热量总是自发地、没有任何限制地从高温物体传到低温物体,正如水总是自发地、没有限制地从高水位流向低水位一样。若要使低温物体的热量传向高温物体,如制冷过程,则必须消耗一定的能量后才能实现。这与低水位的水流向高水位时,必须通过水泵消耗一定能量才能实现一样,消耗能量的过程就是一个补充条件。
(2)开尔文-普朗克表述法 不可能制造出只从一个热源取得热量,使之完全变成机械能而不引起其他变化的循环发动机。
从上述说明可以知道,热功间的相互转换必然会有能量损失,因此,研究热力循环时提高热效率是一项重要任务。
2.热力循环和热效率
如图1-5所示,工质从某一初态1出发,经过一系列状态变化后,又回复到初态1的封闭热力过程,称为热力循环或简称循环。根据循环所产生的不同效果,可分为正循环(或称动力循环)和逆循环(或称制冷循环)。
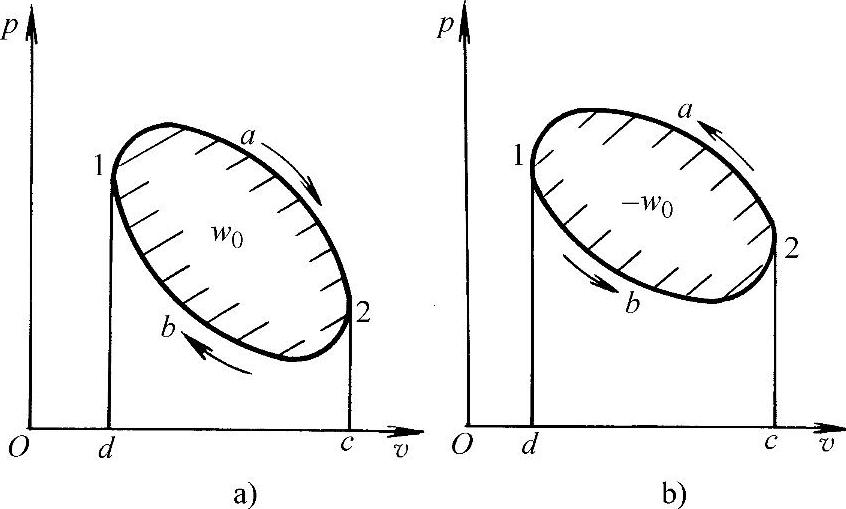
图1-5 热力循环
a)正循环 b)逆循环
正循环是把热能转换为机械能的循环,如图1-5a所示。所有热力发动机都是正循环,按顺时针方向进行。正循环对外所作之净功w0为膨胀功与压缩功之差,在p-v图上为循环曲线所包围的面积1a2b1(正值)。正循环所获得的净功为
w0=q1-q2 (1-18)
式中 q1——工质从高温热源吸进的热量;
q2——工质向低温热源放出的热量。
衡量正循环的经济性,通常用循环热效率ηt评介。循环热效率定义为工质在整个热力循环中,对外界所作的净功w0与循环过程中外界给工质的热量q1的比值,即
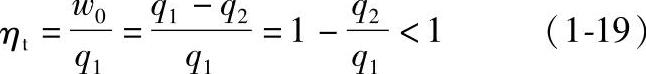
大量实践证明,提高高温热源温度,降低低温热源温度,热机的热效率越高。若热源为恒温热源,高温热源的温度为T1,低温热源的温度为T2,则热效率也可表示为
 (https://www.xing528.com)
(https://www.xing528.com)
逆循环是消耗一定量的机械能,迫使高温热源的热量流向低温热源的循环。压缩式制冷及热泵供热都是利用逆循环工作的,如图1-5b所示。该循环按逆时针方向进行。工质从低温热源吸进的热量为q2,向高温热源放出的热量为q1,逆循环所消耗的净功w0为循环曲线所包围的面积1b2a1(负值)。
根据热力学第一定律,可将逆循环消耗的净功为
-w0=q2-q1或q1=q2+w0 (1-21)
当逆循环为制冷循环时,衡量该循环的经济性采用制冷系数,其定义为
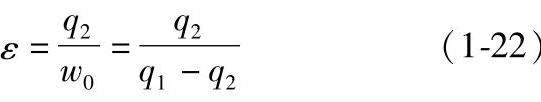
当逆循环为热泵循环时,衡量该循环的经济性采用供热系数,其定义为
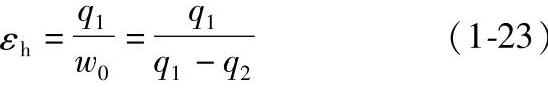
由式(1-22)可知,制冷系数ε可大于1,也可以等于1或小于1。而式(1-23)表示的供热系数εh总大于1,即该循环过程向外界放出的热量总大于消耗的功。
3.比熵及温熵图
比熵是表征工质状态变化时,与外界换热程度的一个导出热力状态参数。对于单位质量工质,称为比熵,用符号s表示,单位为kJ/(kg·K)。与焓一样,熵的绝对值也无法确定,只需知道工质状态变化时熵的变化情况,即用其相对值。单位质量工质在等温加热过程中,从外界加入热量q,加热时的温度为T,加热前后工质的熵分别为s1和s2,对于可逆过程可得
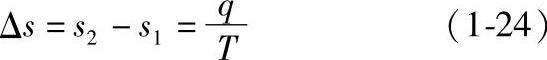
或 q=T(s2-s1) (1-25)
当s2>s1时,q>0,表示工质从外界吸收热量;当s2<s1时,q<0,表示工质对外界放出热量;当s2=s1时,表示等熵过程,或称绝热过程,工质与外界无热量交换。
熵在制冷循环的分析和计算中具有极重要的意义。例如,要把热量由低温物体传到高温物体,这是一个非自发过程,要使这一过程得以实现,必须辅以能量补偿,以使系统总的熵增加。
类比于p-v图,以热力学温度T为纵坐标,比熵s为横坐标组成的温-熵(T-s)图,如图1-6所示。与p-v图一样,图中每一条曲线可代表一个可逆过程。温-熵图中过程曲线1—a—2下面的面积1a2s2s11,表示该过程中工质与外界所传递的热量,因此T-s图又称为示热图。在制冷技术中,T-s图具有重要的实用价值。
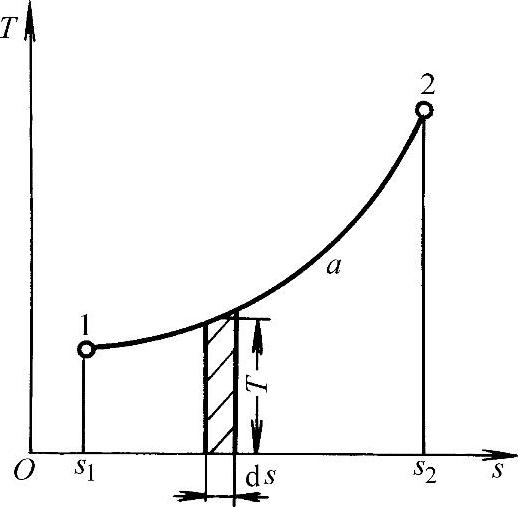
图1-6 温-熵图
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




