1.热力学第一定律
热力学第一定律是能量守恒定律在热力学中的具体体现,它建立起物质能量平衡和相互转换之间的数量关系。根据能量守恒与转换定律,任何一个系统都可表示为
系统收入能量-支出能量=系统储存能量的增量
在热力学中,当系统与外界进行功(W)和热量(Q)变换时,必将引起系统总能量(E)的变化。按能量守恒与转换定律,必然得到
Q=ΔE+W=E2-E1+W (1-11)
即加给系统的热量Q,等于系统总能量的增量ΔE及对外所作功之和。式(1-11)是热力学第一定律的一般表达式,它适用于任何系统、任何过程和任何工质。式中Q、W、ΔE均为代数值。按规定:系统吸热Q为正,反之为负;系统对外作功W为正,反之为负;系统总能量增加ΔE为正,反之为负。
通常热能转换为机械能是通过工质的膨胀实现的,如图1-2所示。当气缸中有单位质量气体被缓慢加热时,则气体逐渐膨胀、压力下降、比体积增加,过程由初态1变化到终态2。设该过程是可逆过程,则在p-v图上通过的途径为1—a—2。如果活塞面积为A,则任一瞬间气体在压力p的作用下,推动活塞移动距离ds所作的膨胀功为
δw=Fds=pAds
因为Ads=dv,所以δw=pdv。
在过程1—a—2中,系统所做的膨胀功为
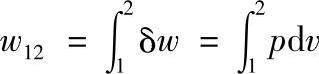
对于m工质所作的功,则为
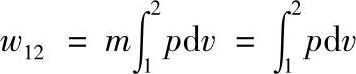
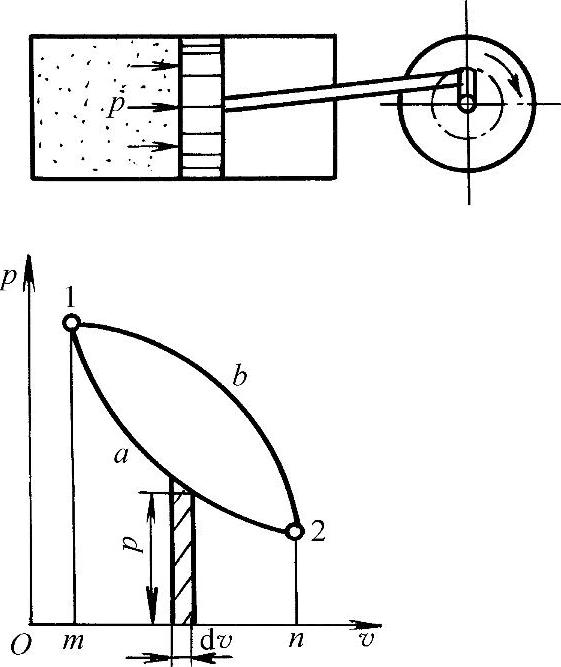
图1-2 膨胀功与p-v图
如果知道工质在状态变化过程中,压力p和比体积v的变化关系,即过程方程式p=f(v)为已知,就可用积分方法求得比功。
由图1-2可知,工质在可逆过程中所作的功,可以用p-v图上过程曲线1—a—2线下的面积来表示,即
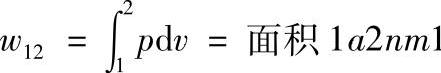
显然,若过程线不同,例如过程按1—b—2线进行,即从同一初态膨胀到同一终态时,过程所完成的功量并不相等,此过程所作的膨胀功为面积1b2nm1。由此可见,膨胀功的数值不仅决定于工质的初态和终态,而且还和过程的途径有关,即与过程的性质有关。
由于在p-v图上可用面积的大小表示功量,所以该图又称为示功图,用该图讨论和分析热机的工作就很方便。
轴功是热力学中经常遇到的另一种功量。系统通过机械轴与外界传递的机械功称为轴功。如果外界功源向刚性绝热闭口系统输入轴功We(见图1-3a),该轴功通过耗散效应转换成热量,被系统吸收,增加系统热力学能。显然,刚性容器中的工质不能膨胀,热量不可能自动地转换为机械功。因此,刚性闭口系统不能向外界输出膨胀功。
图1-3b所示为开口系统与外界传递的轴功We。该轴功可以使系统向外界输出(称正功),如汽轮机、内燃机。也可以是外界向系统输入(称负功),如压缩机、风机、水泵等。
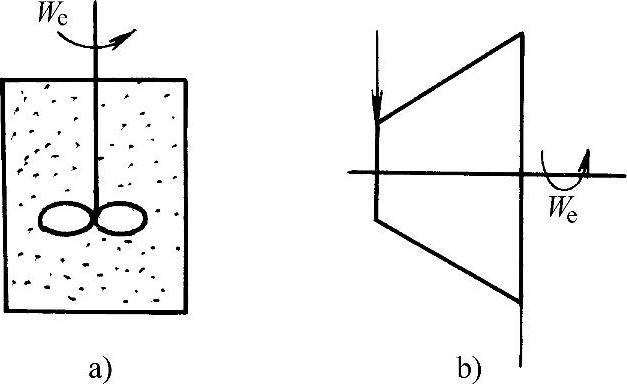
图1-3 轴功
a)闭口系统 b)开口系统
2.热力学能(内能)
在式(1-11)中,E为系统储存的总能量,它包括三种能量:①系统做整体运动时的宏观动能Ek;②在重力场中,系统处于某一高度Z的重力位能Ep;③系统内物质微观运动所具有的热力学能U。因此,系统总能量为
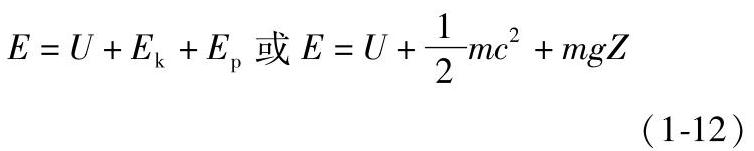
当热力系统静止时,宏观动能和重力位能没有变化,故
ΔE=ΔU(https://www.xing528.com)
在工程热力学讨论的范围内,热力学能是物质微观运动的能量。它是由分子热运动型式的动能和分子间相互作用力形成的内位能所组成,不考虑其他内能,如化学能、原子能等,即工质的热力学能取决于工质的温度和比体积,或者工质的热力状态。它可写成
u=f(T,v)
通常用U表示m工质的热力学能,其单位为J;用u表示单位质量工质的热力学能,称为比热力学能,单位为J/kg。
热力学能的绝对值无法测定,因为物质的运动是永恒的,要想找到一个没有运动而热力学能为绝对零值的基准点是不可能的。在工程计算中,通常只涉及到热力学能的相对变化,所以可任意选取某一状态的热力学能为零,作为计算基准。
3.稳定流动能量方程式及比焓
实际工作的热机多数为开口系统,即系统与外界不仅有能量传递和转换,而且有物质交换。为简化起见,假定负荷是在不变的状态下运行,即视为稳定流动系统。稳定流动是指流道中任何截面上的参数,如压力、温度、比体积及流速等均不随时间而改变。此时,单位时间内系统与外界传递的热量和功,也不随时间而变。
设有一开口系统如图1-4a所示,当单位质量工质流进上述系统时,根据能量守恒与转换定律,可建立下述能量守恒关系式:
(ein+q)-(eout+we)=0 (1-13)
式中 ein、eout——工质流经截面1—1和2—2时带入和流出系统的总能量;
q——系统流过单位质量工质时外界对系统加入的热量;
we——单位质量工质流过系统时对外界输出的轴功。
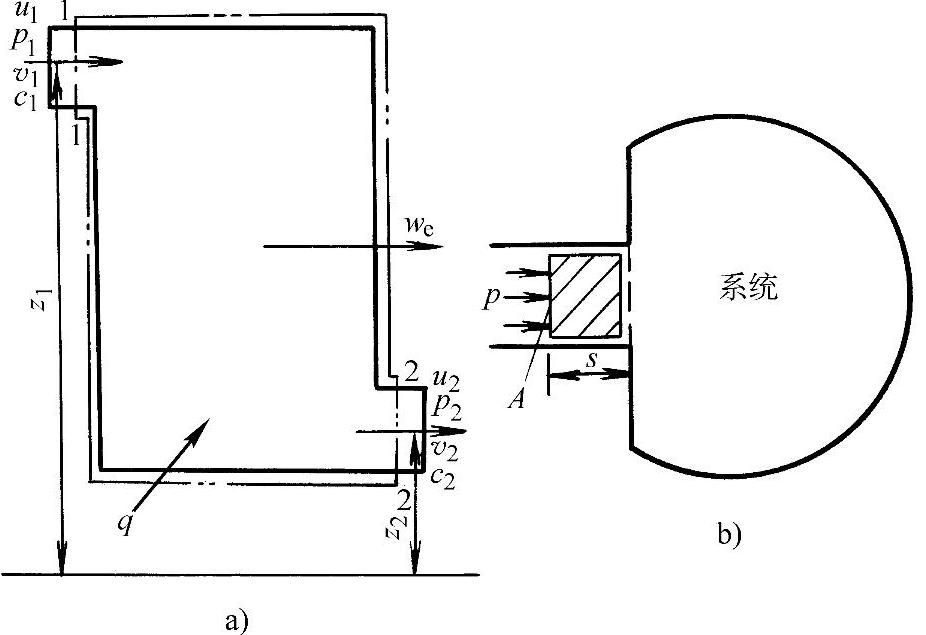
图1-4 开口系统及流动功
a)开口系统 b)流动功
由式(1-12)可知,单位质量工质流进热力系统带入的总能量应为
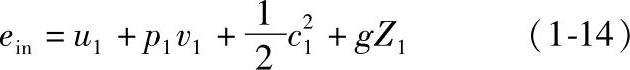
式中 p1v1——单位质量工质在流动时所作的流动功,即它在推动下游工质流动时所产生的功,见图1-4b。
同理单位质量工质流出系统带走的能量为
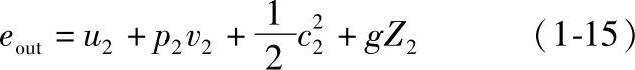
将式(1-14)和式(1-15)代入式(1-13),并整理后得
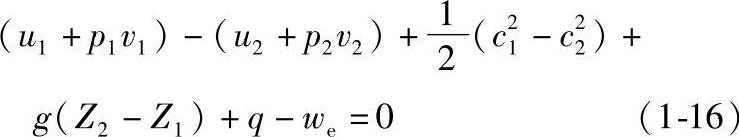
令h=u+pv,这个由状态参数组合而成的新物理量h,依然是一个状态参数,称为比焓,单位为kJ/kg。因此式(1-16)可改写为
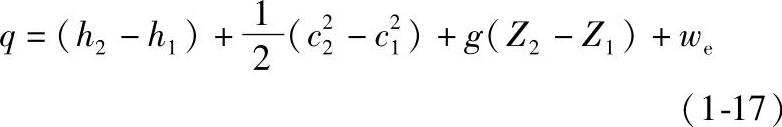
式(1-17)称为稳定流动能量方程式。该方程式对于稳定流动的任何过程(不论可逆与否)、任何工质都适用,它是热工计算中最常用的基本公式之一。
比焓的物理意义是:工质流进(出)热力系统,带入(出)的热力学能和流动功之和。因此,焓可看作是随工质转移的能量。
比焓是工质的一个重要状态参数。引入焓的概念后,给许多热工问题的分析和计算带来方便。例如,工质在流经缩孔或狭缝时,由于克服局部阻力,工质的压力降低,这种现象称为节流。实际制冷装置中,由于制冷剂在节流过程中的速度极快,几乎来不及和外界进行换热,故可以认为节流过程是绝热稳定流动过程,即δq=0;另外,制冷剂与外界无功量交换,δwe=0;若不考虑位能差和动能变化(实际上也是极小或不变),根据稳定流动能量方程式(1-17)并经简化,可得
h1=h2
即制冷剂在绝热节流过程中,节流前的比焓和节流后的比焓相等。但又不能把节流过程看作是一个可逆的等焓过程。因为制冷剂在流经缩孔时,产生了强烈的摩擦扰动,一部分动能用来克服摩擦阻力,而后变为热能被制冷剂本身吸收,气体压力不能回复到原来的压力,所以节流过程是一个典型的不可逆过程。按严格要求,节流过程不能在状态参数坐标图上表示,所以在制冷循环中,均以假拟的虚线表示其过程。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




