热力学是研究热功转换和工质状态变化的。为了弄清功热转换关系,我们先对一些基本概念加以说明。
(一)体系(系统)
体系就是热力学系统,也就是我们分析研究的对象。热力学中常把分析的对象从周围物体中分割出来,研究它通过分界面与周围物体之间热能和机械能的传递,这就是热力学系统,而其周围的物体统称为外界。系统与其外界的分界面叫做边界。
根据热力学系统和外界之间是否有物质的交换来分类,可将热力系统分为闭口系统和开口系统,如图2-2所示。一个热力系统如果和外界只有热或功的交换而没有物质的交换,则该系统称为闭口系统。如果热力系统与外界不仅有能量交换而且有物质的交换,则该系统叫做开口系统,开口系统又叫控制容积或控制体。
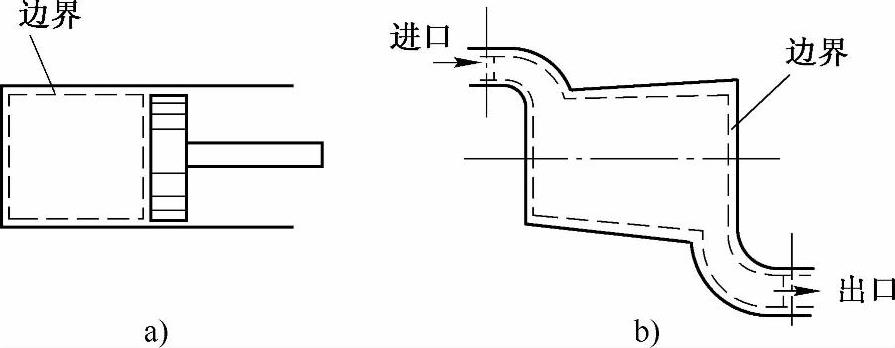
图2-2 体系(系统)
a)闭口系统 b)开口系统
(二)推进功
在开口系统中,工质流进与流出系统必然与功的交换相关联。这个推着工质进入或流出设备的功,称之为推进功。因为这个功只是当工质流动时才存在,所以又称为流动功。
图2-3所示为推进功的推导示意图,在该控制体的工质进口截面上,压力为p1、比体积为v1、截面积为A1、流速为c1。在时间间隔Δτ内,通过进口截面进入体系的气体体积为
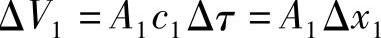
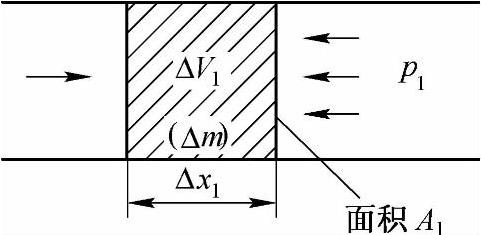
图2-3 推进功的推导
显然,这一体积的气体之所以能进入系统,是由于它上游的气体推动它的结果。上游气体推动这部分气体所做的功为
p1A1Δx1=p1ΔV1
因此,随着这部分气体越过边界进入体系,外界就通过边界向系统输入了p1ΔV1的功。对于流入系统的1kg气体,其体积就是比体积v1,因此外界对1kg气体所做的推进功为p1v1。
同理,在系统出口边界上,系统对1kg气体的推进功为p2v2。(https://www.xing528.com)
(三)热量
工质燃烧过程中所产生的热量,都会遇到与外界发生热量交换的问题,因此需要对热量进行计算。
在工程上,热量的计算是引用比热容这个概念来进行的。
物体温度每升高1K所需要的热量叫热容。单位质量的物体温度升高1K所需要的热量叫比热容,曾称比热,用符号c表示。
在国际单位制中,功的单位是焦[耳](J)或千焦[耳](kJ),热量的单位也是焦[耳](J)或千焦[耳](kJ)。
根据比热容的定义可知,比热容的单位是J/(kg·K)或者kJ/(kg·K)。
质量为m的工质,温度由t1升高至t2时,所需吸收的热量为

试验表明,工质的比热容通常不是一个恒定的常数,它与工质的性质、热量交换的具体过程及工质温度的变化范围有关。
定压过程和定容过程这两种情况下,纵使工质的种类相同,质量相同,温度变化范围也相同,但它们吸收的热量不同。
定压过程中工质的比热容称为比定压热容,用cp表示。定容过程中工质的比热容称为比定容热容,用cv表示。通过实验我们可以知道cp>cv。
而比定压热容与比定容热容的比值

称为比热比。
在热力学中,比定压热容cp、比定容热容cv和比热容之比k具有特别重要的意义,工作中会经常用到。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




