元素水溶液中(25℃)的标准电极电势E°(H)和在LiCl-KCl共晶(45℃)中的熔盐电极电势E°(Pt)(见表2-5),反映了元素的反应性或活泼程度,E°越负越活泼。E°(H)与E°(Pt)的次序大体一致,只是在个别部分E°(Pt)的顺序有所颠倒。从两个序列都可看出,铝比锌要活泼很多,铝表现的稳定全凭氧化膜的保护。
表2-5 元素水溶液中(25℃)的标准电极电势E°(H)和在LiCl-KCl共晶(450℃)中的熔盐电极电势E°(Pt)Table 2-5 Standard electrode potential E°(H)in water solution(25℃)and electromotive force E°(Pt)in molten LiCl-KCl eutectic(450℃)of some elements
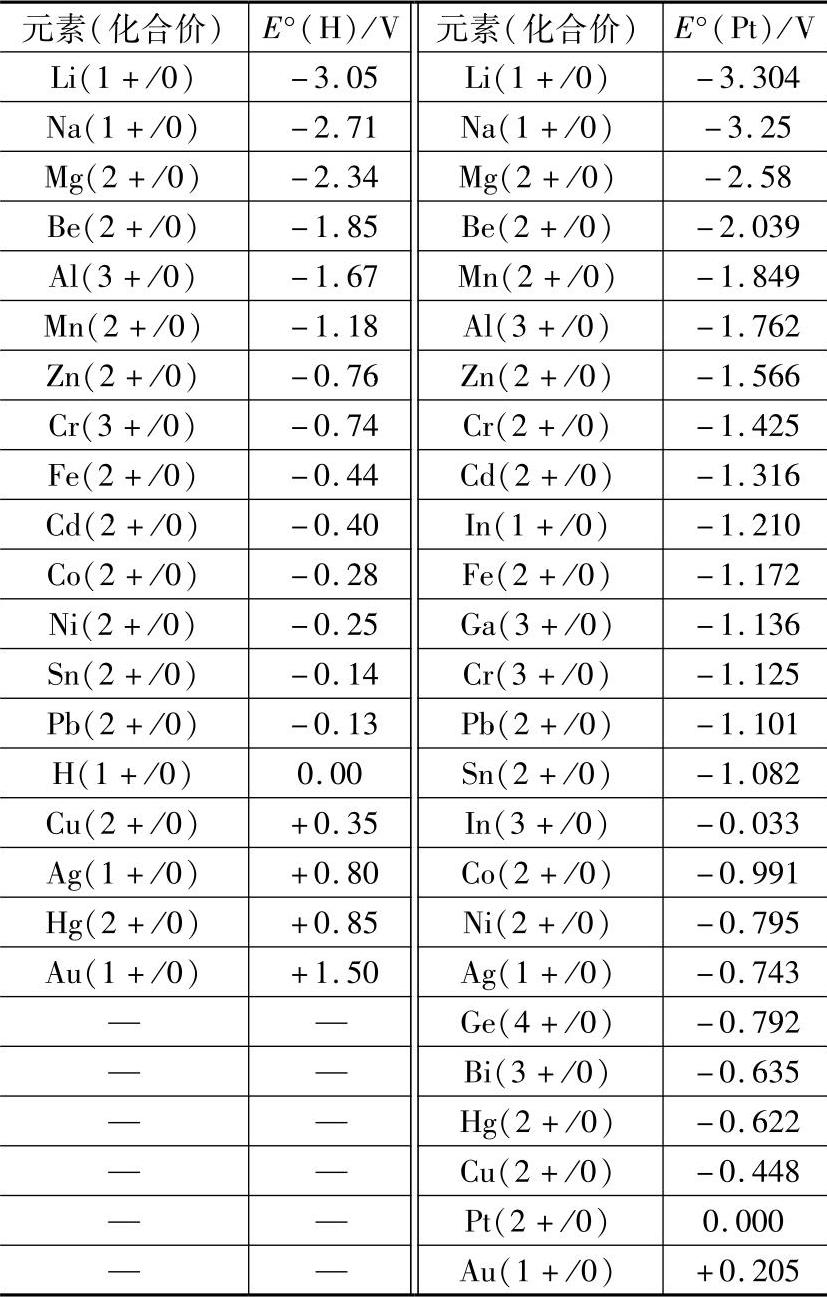
表中两列电位序还说明一个本质问题,即序列靠前的金属如放入序列靠后金属的盐溶液中(左列)或熔融盐中(右列),则前者将把后者的离子还原为金属析出,而自己被氧化为离子进入溶液或熔融盐,例如,将Al插入ZnCl2熔融盐则有:2Al(金属)+3Zn2+=2Al3++3Zn↓的反应,这是母材与钎剂中的一个组分的常见反应。
铝能极缓慢地溶于中等浓度的硝酸,但在浓硝酸中是稳定的,硝酸的浓度越高越稳定。运输发烟硝酸的槽罐是用纯铝做的,这主要是因为硝酸是强氧化性的酸,能使铝氧化生成一层厚的氧化膜的缘故。浓硫酸的氧化性也很强,也较难和铝起反应,但冲稀后的硫酸则易溶解铝。铝易溶于盐酸和氢氟酸中,但在磷酸中钝化不溶。
铝抵抗碱的能力很弱,易溶于NaOH、KOH的水溶液中生成铝酸盐NaAlO2或KAlO2同时放出氢气
2Al+2NaOH+2H2O=2NaAlO2+3H2↑ (2-1)
有趣的是,卖气球的小贩都懂得用这一反应,将废铝和烧碱溶液反应产生氢气来冲灌氢气球。也告诉人们需要警惕的是,将铝和烧碱堆放在一起是危险的。(https://www.xing528.com)
铝表面上的氧化膜也能和碱反应
Al2O3+2NaOH=2NaAlO2+H2O (2-2)这一反应常用来清除铝表面的腐蚀产物和过厚的氧化膜,当发现反应液中产生大量氢气泡时,说明已经和基底铝按照式(2-1)反应。过量反应将使铝材表面产生大小不等的火山口似的微观凹坑(见图2-46)。
所有重金属离子的电极电势都比铝的正(见表2-5),因此铝和它们的溶液接触时,由于置换反应而产生铝溶解而重金属离子沉积。在无水熔盐中情况也一样。沉出的重金属和铝便形成电偶,在铝表面上造成无数微电池促进其电化腐蚀。在重金属盐中以汞的盐给铝及铝合金造成的伤害最大,远远不只是表面腐蚀,而会深入母材内部形成晶间断裂的破坏。汞盐包括HgCl2、Hg(NO3)2、HgSO4等,在被铝还原后析出金属Hg并形成合金汞齐。Al-Hg合金在室温是液态,此时氧化膜不能保持完整。这个过程一旦开始便会永久持续地进行下去。在潮湿环境中汞齐中的Al立即被氧化,多余的汞则和下面的Al生成新的汞齐,如此反复向下方母材深处挺进,直至Al全部被氧化为Al(OH)3。和Al接触的反应物中即使Hg的浓度低于万分之一,也会产生可见的影响。因此在Al的钎焊工艺中,无论是清洗液、钎剂、钎料以及一切可能与母材接触的物料中都不允许有汞及其离子存在。应该指出,在高于30℃的室温下镓及其盐也有类似的破坏情况[130-133]。
由以上的叙述可以看出,一些含Cu、Zn等元素的铝合金的耐电化学腐蚀能力都会较差。为了提高商品铝合金材料的耐蚀性,常在板材或管材外部包覆一层低于1/10厚度的保护合金层,这层合金的电极电位设计得以比芯材低0.1V左右,起到阴极保护作用。不同的合金有专有的保护层搭配[4]289,含Cu的硬铝,例如,2A12(2024)常包覆一层纯Al保护。当用NaOH溶液清洗这类合金工件时,容易发现断面因含Cu而结构裸露,与NaOH反应有黑色的CuO生成,而表面因为纯铝层保护并不发黑。此反应常用来作为判断含Cu类合金的简便手段。稀硝酸的最后清洗可以溶去生成的CuO而使工件恢复原来的色泽。清洗硬铝类合金时,应注意不使表面铝的被覆层被NaOH溶穿。
铝的钝化区也即氧化膜的稳定区在环境pH值为4~8.5。低于此值下限的酸性溶液中会生成Al3+,高于此值上限的碱性溶液中则会生成AlO-2。在pH处于4~8.5时虽较稳定,但如环境溶液中含盐量较高则易产生孔蚀。Al对F-、Cl-、Br-、I-的耐蚀性依次减低。
钎料与铝母材合金化以后形成的钎缝或焊点与母材构成了电偶,在电解质溶液或潮湿空气中电化腐蚀在所难免。焊点与母材之间的边界越分明,电化腐蚀越厉害。钎料与母材形成固溶体过渡则具有较优的耐腐蚀性。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




