1.基于门和属水平的真菌多样性分析
采用MiSeq高通量测序技术从10个米酒样品中共检测出85 672条有效序列,本研究首先对测序深度进行分析,结果如图4-8所示。

图4-8 样品真菌序列稀释曲线(A)和香农指数曲线(B)
由图4-8可知,稀释曲线(A)随着序列数的增加呈现逐渐上升的趋势,而香农指数曲线(B)在序列数为10 000条左右时就已全部进入稳定期,说明随着测序序列量的增加样品中可能会有新的物种会被发现,但其真菌多样性不会再有明显变化了,表明本研究测得的85 672条序列满足后续生物信息学分析要求。由图4-8(B)可知,所有样品中香农指数最大的为MJ4,最小的为MJ8,经α多样性分析发现在测序深度为34 810条序列时二者的香农指数分别为4.36和0.99,说明样品MJ4中真菌丰富度最高而样品MJ8中最低。本研究检测出的合格序列在97%的相似度可划分为10 627个OTU,从每个OTU中挑选一条代表性序列进行比对然后统计其界、门、纲、目、科和属的种类和数量,其中真菌门水平的分析结果如图4-9所示。

图4-9 米酒中优势真菌门相对含量分析
由图4-9可知,所有米酒样品中主要检测出隶属于Ascomycota(子囊菌门)、Mucoromycotina(毛霉亚门)、Basidiomycota(担子菌门)、Chytridiomycota(壶菌门)和Blastocladiomycota(芽枝霉门)的真菌,其中Ascomycota和Mucoromycotina的累积平均相对含量高达99.20%,而Basidiomycota、Chytridiomycota和Blastocladiomycota仅在一个或少数几个样品中存在。由图4-9亦可知,MJ1和MJ4中Ascomycota的相对含量明显低于其他样品,而MJ5、MJ7和MJ8中Basidiomycota含量亦明显低于其他样品,说明各样品中真菌门的种类和含量存在差异。进一步在属水平上进行研究时发现10个样品共检测出17个真菌属,其中平均相对含量大于0.1%的有4个,在本研究中将这4个真菌属定义为优势真菌属,则其在各样品中的分布情况如图4-10所示。

图4-10 米酒中优势真菌属相对含量分析
由图4-10可知,米酒样品中的优势真菌属主要为Saccharomycopsis(复膜孢酵母属)、Rhizopus(根霉属)、Amylomyces(淀粉霉)和Poitrasia(暂无中文翻译),其平均相对含量分别为62.44%、20.28%、4.42%和0.47%,所有合格序列仅有12.17%不能鉴定到属水平。值得一提的是,Saccharomycopsis在MJ1中的相对含量仅有10.39%,而在MJ8中的相对含量高达92.54%;Rhizopus在MJ1中的相对含量为64.32%,而在MJ5、MJ7和MJ8中的相对含量分别为0.43%、2.43%和2.02%;样品MJ1和MJ10中均不含有Poitrasia。由此可见,虽然米酒样品中含有大量真菌菌群,但这些优势真菌在各样品中并非均匀分布。焦晶凯[21]采用DGGE技术对不同发酵时期传统酿造米酒中微生物多样性变化进行分析,发现米酒中含有的真菌主要为Saccharomyces(酵母属)、Pichia(毕赤酵母属)和Kluyveromyces(克鲁维酵母属),与本研究结果存在一定差异性;但王丹丹[15]采用MiSeq高通量测序技术对孝感凤窝酒曲真菌微生物多样进行研究时发现淀粉霉(Amylomyces)、小克银汉霉属(Cunninghamella)、毛霉属(Mucor)、复膜孢酵母属(Saccharomycopsis)、曲霉属(Aspergillus)、念珠菌(Candida)、拟威尔酵母(Cyberlindnera)和接合酵母(Zygosaccharomyces)是其内主要真菌,与本研究结果较为相似,出现这种现象的原因可能是原料来源和实验方法等因素造成的。
2.基于OTU水平的真菌多样性分析
本研究从10个米酒样品中得到10 627个OTU,各样品中OTU数量及种类并非完全相同,如图4-11所示为各OTU在所有样品中出现次数统计结果。

图4-11 OTU出现次数统计分析(https://www.xing528.com)
由图4-11可知,随着OTU出现频次从1到10逐渐升高,其所含OTU数占总OTU数的比例整体上呈现逐渐下降的趋势,而所含序列数占总序列数的比例趋势恰好相反,尤以出现频次为1和10的OTU最为明显。某个样品中特有的OTU即图4-11所示仅出现1次的OTU占总OTU数的比例为75.74%,但其所含序列数仅为2.30%;出现10次的OTU即所有样品共有OTU占总OTU数的比例仅为0.40%,而其所含序列数占到总序列数的83.82%;其他频次的OTU即部分样品中共有OTU的OTU比和序列比值总体上较为相近。说明样品中特有真菌种类多但在各样品中的含量少,而多数为共有真菌菌群。值得一提的是,10 627个OTU中序列平均相对含量大于0.1%的OTU有32个,其中相对含量大于0.5%有7个,这7个OTU在各米酒样品中的相对含量如图4-12所示。
由图4-12可知,平均相对含量大于0.5%的OTU及其平均相对含量分别为OTU2793(45.40%)、OTU8553(16.41%)、OTU2342(15.90%)、OTU4367(1.18%)、OTU9019(0.63%)、OTU4274(0.59%)和OTU5981(0.53%),其中OTU2793、OTU2342和OTU4274隶属于Saccharomycopsis,OTU8553、OTU4367和OTU5981隶属于Rhizopus,OTU9019隶属于Amylomyces,且这些OTU在各样品中均存在。由图4-12亦可明显看出,MJ8中OTU2342的相对含量已达92.47%,显著高于其他样品,而其OTU2793的相对含量仅为0.02%。由此可见,米酒样品中的核心优势真菌属为Saccharomycopsis、Rhizopus和Amylomyces,且各样品相对含量存在差异。

图4-12 平均相对含量大于0.5%的OTU统计分析
3.样品差异分析
通过计算样品间的距离,UniFrac显著性检验可利用各样品序列类型来比较样品在特定的进化谱系中是否有显著的微生物群落差异[22]。本研究在对不同米酒样品中真菌进行分析鉴定的基础上进一步采用基于分类操作单元加权UniFrac距离显著性检验对样品间差异性进行了分析,结果如图4-13所示。

图4-13 样品UPGMA 聚类分析
由图4-13可知,采集的10个米酒样品大致可以分为两类,聚类Ⅰ包括MJ1、MJ2、MJ4、MJ6、MJ9和MJ10,聚类Ⅱ包括MJ3、MJ5、MJ7和MJ8。在加权UniFrac中,分支的长度由树的该分支的两个群落的相对丰度的差异进行加权所得,由图4-13亦可知,聚类Ⅰ中各分支长度整体上要长于聚类Ⅱ各分支,为探究其差异显著性,本研究进一步采用欧氏距离对样品真菌群落结构组间差异进行分析,结果如图4-14所示。

图4-14 基于欧氏距离的样品真菌群落结构组间差异分析
由图4-14可知,采用欧氏距离计算不同聚类真菌微生物群落结构差异时,聚类Ⅰ的组内距离为0.082±0.028(平均值±标准差),聚类Ⅱ的组内距离为0.047±0.014(平均值±标准差),即聚类I中的欧氏距离大于聚类Ⅱ,说明聚类Ⅰ中样品相似度低于聚类Ⅱ。经Mann-Whitney检验发现两组数据差异显著(p=0.038),说明聚类Ⅰ样品真菌群落结构组内差异要明显高于聚类Ⅱ(p<0.05)。本研究进一步在属水平上对造成上述现象的因素进行了探究,结果如表4-3所示。
表4-3 不同聚类间优势真菌属差异分析
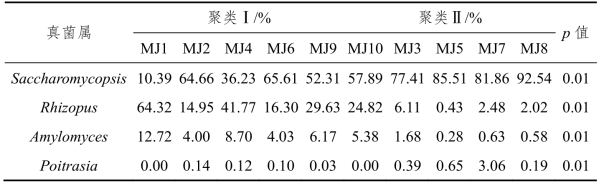
由表4-3可知,聚类Ⅰ和聚类Ⅱ中Saccharomycopsis、Rhizopus、Amylomyces和Poitrasia的相对含量差异均非常显著(p<0.01)。整体上看,聚类Ⅰ中Rhizopus和Amylomyces的相对含量上要高于聚类Ⅱ,而聚类Ⅱ中Saccharomycopsis和Poitrasia要高于聚类Ⅰ。由此可见,Saccharomycopsis、Rhizopus、Amylomyces和Poitrasia是造成米酒样品两个聚类微生物群落结构差异显著的关键真菌类群。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




