1.米酒中细菌PCR-DGGE分析
本研究首先将10个米酒样品中细菌16s rRNA V3片段进行PCR-DGGE分析,电泳图谱如图4-1所示。

图4-1 米酒中细菌PCR-DGGE图谱
由图4-1可知,在电泳图谱中共发现10条特征性条带。其中条带1、2、3和8存在于每个样品中,但是亮度却不一致,说明各样品中存在相同的细菌但是丰度却不相同。条带5存在于MJ1、MJ2、MJ4、MJ7和MJ10样品中且亮度不同,条带4、6和7仅存在于MJ5样品中,条带9和10仅在MJ1和MJ3中没有表现出来。由图4-1知,10条特异性条带在MJ5样品中均有较高的亮度,说明MJ5样品中细菌群落组成具有较高多样性且各条带代表的丰度较高,而MJ3样品中仅存在4条特异性条带且亮度较暗,说明MJ3样品细菌群落组成少且丰度较低。进一步将各条带所代表的序列进行同源性比对,结果如表4-1所示。
表4-1 DGGE指纹图谱中条带比对结果

续表

由表4-1可知,条带1隶属于Weissella,条带2隶属于Enterococcus,条带3、8和10隶属于Pediococcus,条带4、6和7隶属于Kosakonia,同时条带5和9隶属于Lactobacillus。本试验进一步采用Neighbor-Joining(邻接法)对上述特征条带序列与数据库中16s rRNA模式菌株进行系统发育树的构建,结果如图4-2所示。
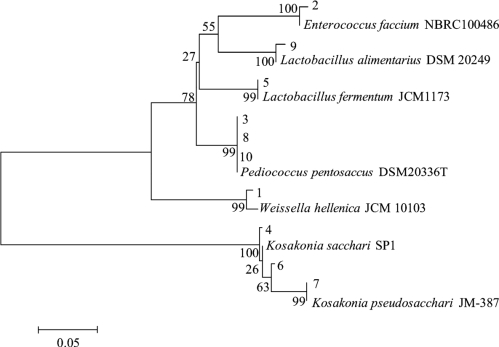
图4-2 DGGE指纹图谱中条带系统发育树
由图4-2可知,系统发育树被分为两大分支,其中条带4、6和7聚类在一个分支上,其余条带聚类在另一分支,同时发现各条带菌株代表的序列与模式菌株具有较高的相似度。值得一提的是,本研究使用引物ALL-GC-V3F/ALL-V3R,以16s rRNA的V3区为扩增靶点对细菌的多样性进行解析,然而V3区序列长度较短,为了结果准确性本研究仅将鉴定结果明确至属水平。张振东在16个来源不同的米酒样品中发现Enterococcus、Streptococcus、Lactobacillus、Pediococcus以及Weissella存在于所有米酒样品中,证明了米酒样品中细菌多样性较高[24]。苗乘源利用聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)与传统微生物培养方法相结合的手段对朝鲜传统米酒中的菌株进行分析,结果发现Lactobacillus fermentum参与米酒发酵的整个过程[25]。相飞采用PCR-DGGE技术分析发现甜酒曲中存在Weissella kimchi、Enterococcus faecium和Herbaspirillum sp.等细菌[26]。上述3个研究的结论与本研究基本一致。
2.米酒中细菌MiSeq高通量测序分析
为了克服DGGE技术通量低的不足,本研究进一步使用MiSeq高通量测序技术对10个米酒样品的细菌多样性进行了分析,其16s rRNA测序情况及各分类地位数量如表4-2所示。
表4-2 样品16s rRNA测序情况及各分类地位数量

由表4-2可知,10个米酒样品中共产生575 616条序列,平均每个样品产生57 562条序列。本试验首先根据序列的100%相似性归类获得123 817条具有代表性的序列,根据97%相似性归类共得到7 147个OTU,平均每个样品715个OTU。当测序量为52 010条序列时,MJ5样品的Chao 1指数和Shannon 指数达到最大值,分别为1 110和5.64,说明此时MJ5样品中细菌群落丰富度和多样性均为最高,这与DGGE结果一致。
纳入本研究的序列被鉴定为27个门,80个纲,122个目,173个科,285个属,仅有1.98%和8.75%未鉴定到门和属水平。米酒中平均相对含量大于>1%的门如图4-3所示。(https://www.xing528.com)

图4-3 米酒中优势细菌门相对含量分析
由图4-3可知,10个米酒样品中平均相对含量>1%的门分别为Firmicutes、Proteobacteria和Bacteroidetes,其平均相对含量分别为81.53%、13.03%和2.78%。进一步分析发现Firmicutes在样品MJ6、MJ8和MJ9中较高,相对含量分别为99.84%、99.26%和99.34%,Proteobacteria在样品MJ5中较高,相对含量为87.69%。本研究进一步在属水平上对各样品的细菌多样性进行了分析,结果如图4-4所示。

图4-4 米酒中优势细菌属相对含量分析
由图4-4可知,10个米酒样品中共有5个细菌属的平均相对含量>1%,分别为Pediococcus、Enterococcus、Weissella、Kosakonia和Prevotella,其平均相对含量分别为58.03%、10.72%、8.24%、3.34%和2.01%。进一步研究发现,Pediococcus为样品MJ3、MJ4、MJ6、MJ7、MJ8和MJ9中含量最多的细菌,相对含量分别为76.32%、89.50%、88.02%、93.71%、93.31%和96.72%。Pediococcus和Prevotella为MJ1中的优势细菌属,相对含量分别为21.35%和19.87%;Enterococcus、Weissella和Kosakonia分别为样品MJ1、MJ10和MJ5中含量最多的细菌,相对含量分别为97.56%、67.79%和33.32%。有研究人员亦采用高通量测序技术对米酒曲中的细菌多样性进行了解析。采用单分子实时测序技术,韩琬对3个日本米酒曲样品的细菌多样性进行了分析,结果发现米酒曲中的细菌主要隶属于Actinobacteria、Bacteroidetes、Firmicutes、Proteobacteria和Verrucomicrobia,而Proteobacteria为优势细菌门[27]。利用MiSeq高通量测序的方法,沈馨在3个孝感凤窝酒曲中发现优势细菌属为隶属于Firmicutes的Weissella、Enterococcus、Lactococcus和Bacillus细菌属[20]。
本研究进一步统计了OTU在10个米酒样品中出现次数及相对含量,结果如图4-5所示。

图4-5 OTU出现次数与其包含序列的相对含量
由图4-5可知,本研究共产生7 147个OTU,仅出现1次的OTU为6 008个,占OTU总数的84.06%,但其序列仅占总序列数的4.15%。值得注意的是出现10次的OTU有6个,仅占OTU总数的0.08%,而序列数占总序列的58.72%。本研究进一步对核心OTU的相对含量进行了分析,结果如图4-6所示。

图4-6 核心OTU相对含量分析
由图4-6可知,6个核心OTU分别为OTU5645、OTU59、OTU6688、OTU1966、OTU4807和OTU447,其平均相对含量分别为54.74%、0.80%、0.76%、0.33%、0.30%和0.10%。由于第二代高通量测序不能鉴定到种水平,只能确定其细菌属。进一步分析发现OTU5646隶属于Pediococcus,OTU59隶属于Ralstonia,OTU6688隶属于Herbaspirillum,OTU1966隶属于Acinetobacter,OTU4807隶属于Burkholderia和OTU447隶属于Pseudomonas。由此可见,Pediococcus为恩施地区米酒样品中的优势细菌。
3.米酒中乳酸菌菌株的分离与鉴定
本研究进一步对米酒中的乳酸菌进行了分离鉴定,并将测序结果与数据库中的模式菌株构建了系统发育树,结果如图4-7所示。
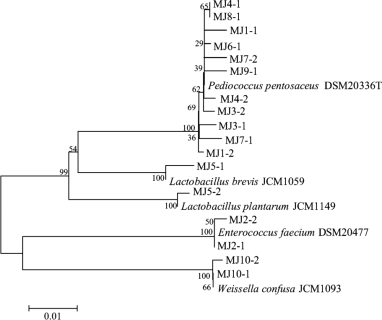
图4-7 米酒中乳酸菌系统发育树
由图4-7可知,在米酒中共分离鉴定出17株乳酸菌,其中有11株鉴定为Pediococcus pentosaceus,2株鉴定为Enterococcus faecium,2株鉴定为Weissella confusa,1株鉴定为Lactobacillus brevis,1株鉴定为Lactobacillus plantarum。由此可知,恩施地区米酒中的优势乳酸菌为Pediococcus pentosaceus,这与PCR-DGGE及MiSeq高通量测序结果一致。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




