1.泡菜水中乳酸菌的分离鉴定
本研究共从5份泡萝卜中分离出18株潜在乳酸菌菌株,其中17株为杆菌,1株为球菌,所有菌株在含有1.0%碳酸钙的MRS上均能形成透明圈且菌落呈乳白色、革兰氏染色均为阳性、过氧化氢酶实验均为阴性。在对菌株基因组DNA进行提取的基础上,本研究采用琼脂糖凝胶电泳技术对其纯度和浓度进行了检测,并通过凝胶成像仪成像观察,结果如图2-21所示。
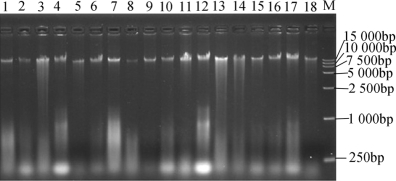
图2-21 基因组DNA凝胶电泳图
泳道1~3:HBUAS51051~51053;泳道4~6:HBUAS51055~51057;泳道7~12:HBUAS51059~51064;泳道13~18:HBUAS51066~51071;M:DL15000maker;图2-22同。
由图2-21可知,每个泳道在20 000 bp左右均出现了荧光条带,但部分条带有拖尾现象,同时少数条带亮度偏弱,由此可见,虽然本研究提取的不同菌株基因组DNA的浓度和纯度存在一定的差异性,但基本都满足后续16s rRNA扩增的要求。在对18株潜在乳酸菌菌株16s rRNA基因进行PCR扩增后,本研究亦采用琼脂糖电泳技术对其扩增产物浓度和纯度进行了检测,结果如图2-22所示。
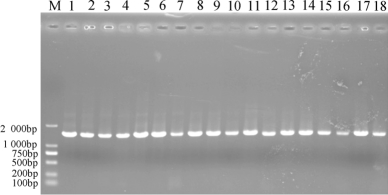
图2-22 PCR扩增产物凝胶电泳图
由图2-22可知,所有泳道在1 500 bp左右均出现荧光条带,条带清晰、亮度较高且无明显拖尾现象,因而所有潜在乳酸菌菌株16s rRNA基因PCR扩增成功,可用于后续清洁、连接、转化和核苷酸序列测定。本研究进一步登陆NCBI网站,将各菌株反馈后的序列采用BLAST方法进行比对,选取相似度较高且已公布的乳酸菌模式种的16s rRNA基因序列构建系统发育树,进而明确分离株的种属分类学地位,系统发育树如图2-23所示。

图2-23 乳酸菌16s rRNA基因系统发育树
由图2-23可知,根据16s rRNA基因的系统发育分析,1株球菌鉴定为Pediococcus pentosaceus(戊糖片球菌),而其他17株杆菌分别被鉴定为Lactobacillus(乳酸杆菌属)的5个种,其中菌株HBUAS51059和HBUAS51060被鉴定为L.alimentarius(食品乳杆菌),菌株HBUAS51064、HBUAS51070和HBUAS51071被鉴定为L.brevis(短乳杆菌),菌株HBUAS51062和HBUAS51063被鉴定为L.paracasei(副干酪乳杆菌),菌株HBUAS51051和HBUAS51052被鉴定为L.fermentum(发酵乳杆菌),而其他8株菌株均被鉴定为L.plantarum(植物乳杆菌)。由此可见,恩施地区泡萝卜中乳酸菌具有较高的多样性,且L.plantarum为其优势乳酸菌类群,占分离株总数的44.44%。根据卫计委印发的《可用于食品的菌种名单》(2016版)规定,L.alimentarius不能用于食品的加工,因而本研究进一步使用除L.alimentarius外的16株乳酸菌分离株进行了泡萝卜的纯种发酵。
2.乳酸菌纯种发酵泡萝卜色泽和质构的评价
有研究指出自然发酵的泡菜在发酵过程中常出现“生花”的现象,一旦膜醭出现不仅难以清除,同时会使泡菜水颜色发暗且泡菜口感偏软[3],虽然在乳酸菌纯种发酵制备泡萝卜的过程中没有出现“生花”现象,但本研究亦采用色度仪和质构仪分别对泡萝卜水和泡萝卜的色泽和质构进行了评价,结果如表2-13所示。
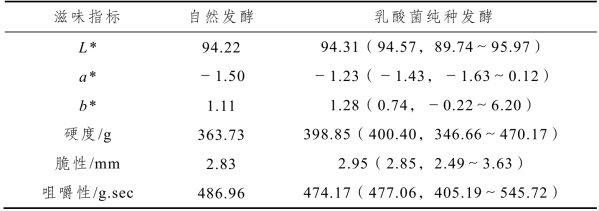
表2-13 不同处理泡萝卜水色度和泡萝卜质构指标的比较分析
 (https://www.xing528.com)
(https://www.xing528.com)
注:94.31(94.57,89.74~95.97),平均值(中位数,最小值~最大值),表2-14同。
由表2-13可知,较之自然发酵的泡萝卜,乳酸菌纯种发酵制备的多数样品其L*和a*偏大,而b*呈现出相反的趋势,这说明乳酸菌纯种发酵的泡萝卜水颜色偏亮、偏红和偏蓝[14]。值得一提的是,乳酸菌纯种发酵制备的多数泡萝卜样品硬度和脆性均明显高于自然发酵样品,而咀嚼性呈现出相反的趋势。由此可见,乳酸菌纯种发酵可明显提升泡萝卜的质构品质。
3.乳酸菌纯种发酵泡萝卜典型风味物质的评价
在对泡菜水色泽和泡萝卜质构进行评价的基础上,本研究进一步使用电子鼻技术对不同泡萝卜水中典型风味物质的含量进行了分析,结果如表2-14所示。
表2-14 不同处理泡萝卜水中典型风味物质的比较分析

由表2-14可知,传感器W1C、W3C和W5C对多数乳酸菌纯种发酵泡萝卜水的响应值明显偏高,而W6S、W1S、W2S、W2W和W3S呈现出相反的趋势,因传感器W1C、W3C和W5C主要对芳香类物质敏感,因而乳酸菌纯种发酵可明显提升多数泡萝卜水挥发性风味物质中的芳香类物质。
4.基于PCA乳酸菌纯种发酵泡萝卜品质的评价
本研究使用PCA,采用降维的方法对乳酸菌纯种发酵泡萝卜的品质进行了进一步评价,第一主成分(Principal Component 1,PC1)、PC2、PC3和PC4的贡献率分别为42.44%、22.34%、11.70%和10.27%,前4个PC的累计方差贡献率为86.76%。PC1由W1C、W5S、W3C、W5C和W2S 5个风味指标构成;PC2由W1W、W2W、L*和b* 4个指标构成;PC3由脆性和咀嚼性2个质构指标构成;PC4由W6S、W1S、W3S、硬度和a* 5个指标构成。因咀嚼性和脆性为泡萝卜的特征性指标,因而本研究选取PC1和PC3进行了因子载荷图的绘制,结果如图2-24所示。
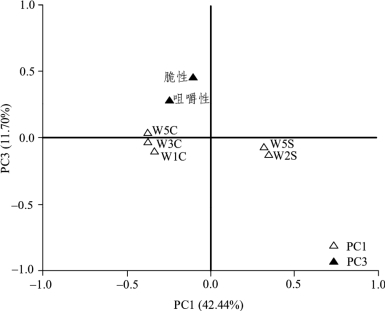
图2-24 基于PCA的乳酸菌纯种发酵泡萝卜品质的因子载荷图
由图2-24可知,PC1中W5S和W2S 2个风味缺陷型指标偏向X轴正方向,W1C、W3C和W5C 3个风味特征性指标偏向X轴负方向,PC3中脆性和咀嚼性指标偏向Y轴正方向,因而在因子得分图中排布于第二象限的样品其品质最佳,排布于第一三象限的次之,而排布于第四象限的品质最差。基于PC1和PC3的因子得分图如图2-25所示。
由图2-25可知,不同乳酸菌分离株纯种发酵制备的泡萝卜样品在空间排布上较为分散,在4个象限均有分布,这说明不同菌株间的发酵特性差异较大,其中多数样品的空间排布较之自然发酵组偏左上方,因而这进一步证实了乳酸菌纯种发酵可明显提升多数泡萝卜的品质。由图2-25亦可知,菌株L.paracasei HBUAS51063和L.plantarum HBUAS51053纯种发酵制备的泡萝卜样品最偏左上方,因而该两株菌具有相对较佳的发酵特性,可进一步用于后续泡菜用乳酸菌菌株的筛选。
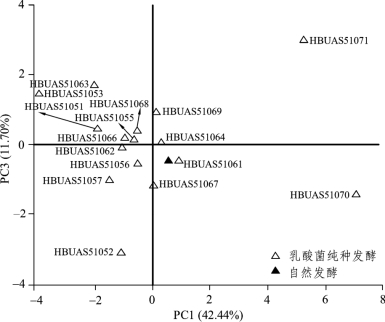
图2-25 基于PCA的乳酸菌纯种发酵泡萝卜品质的因子得分图
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




