根据化学反应,除了生产纯氧,ITM同样可以应用到合成气的生产:

合成气,也就是CO和H2,是很多化学合成的原料。Ritchie等人(2004)已详细研究过它的生产过程。Korobitsyn等人(2000)在ECN做了大量的分析。因为甲烷的转换率高于95%,所以在计算中假设反应器的操作温度是1121℃,操作压力为27bar。通过膜的氧的通量为10Nml/cm2×min=2.3gO2/m2×s。如果在上面提到的ITM分离单元能达到这样的通量,它的大小将在每一尺度上少(2.3/0.0522)1/3=3.47,即约为2.1×2.1×2.1m3=9.26m3。
这个应用的实质是甲烷的进一步氧化,它的完整的氧化为
CH4+2O2⇒CO2+2H2O(5-2)
式(5-1)是吸热反应,与其相反,式(5-2)是放热反应。这就是著名的甲烷燃烧的反应。和普通的燃气轮机和活塞发动机的燃烧室不同的是,使用ITM装置能使燃烧的产物、CO2和水不被N2稀释。在环境温度下,处于液态的水更容易从气态的CO2中分离出来。因为后者构成了准联合零排放循环的工作流体,所以只将一部分(5%~10%)高压气流用于随后的封存并没有任何困难。
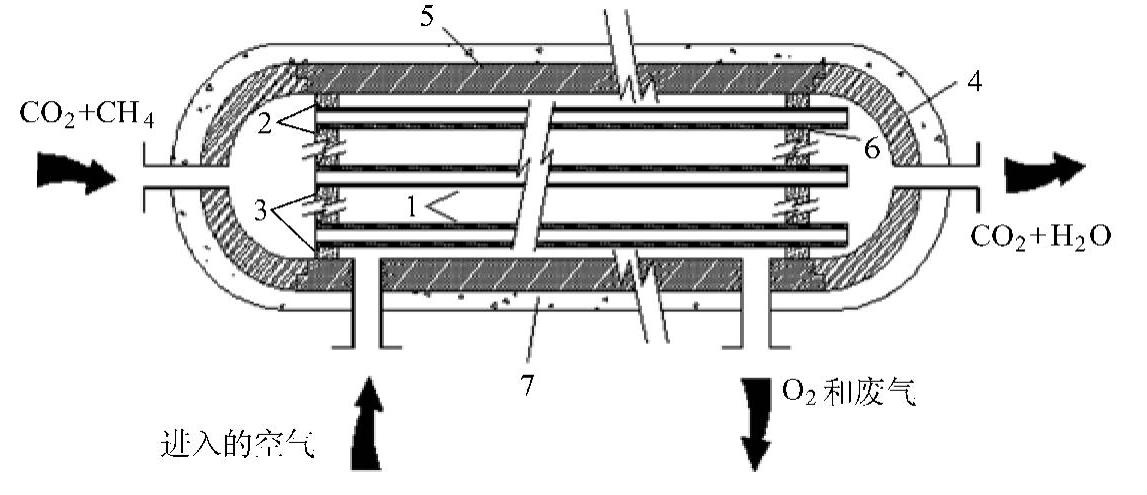
图5-2 ITM反应器燃烧室(与图4-8相似)(https://www.xing528.com)
1—ITM陶瓷管 2—钢和陶瓷的焊接套(氩弧焊) 3—钢管阀盘 4—节流阀端盖 5—钢外壳(不锈钢) 6—排气口 7—绝缘热材料(石英)
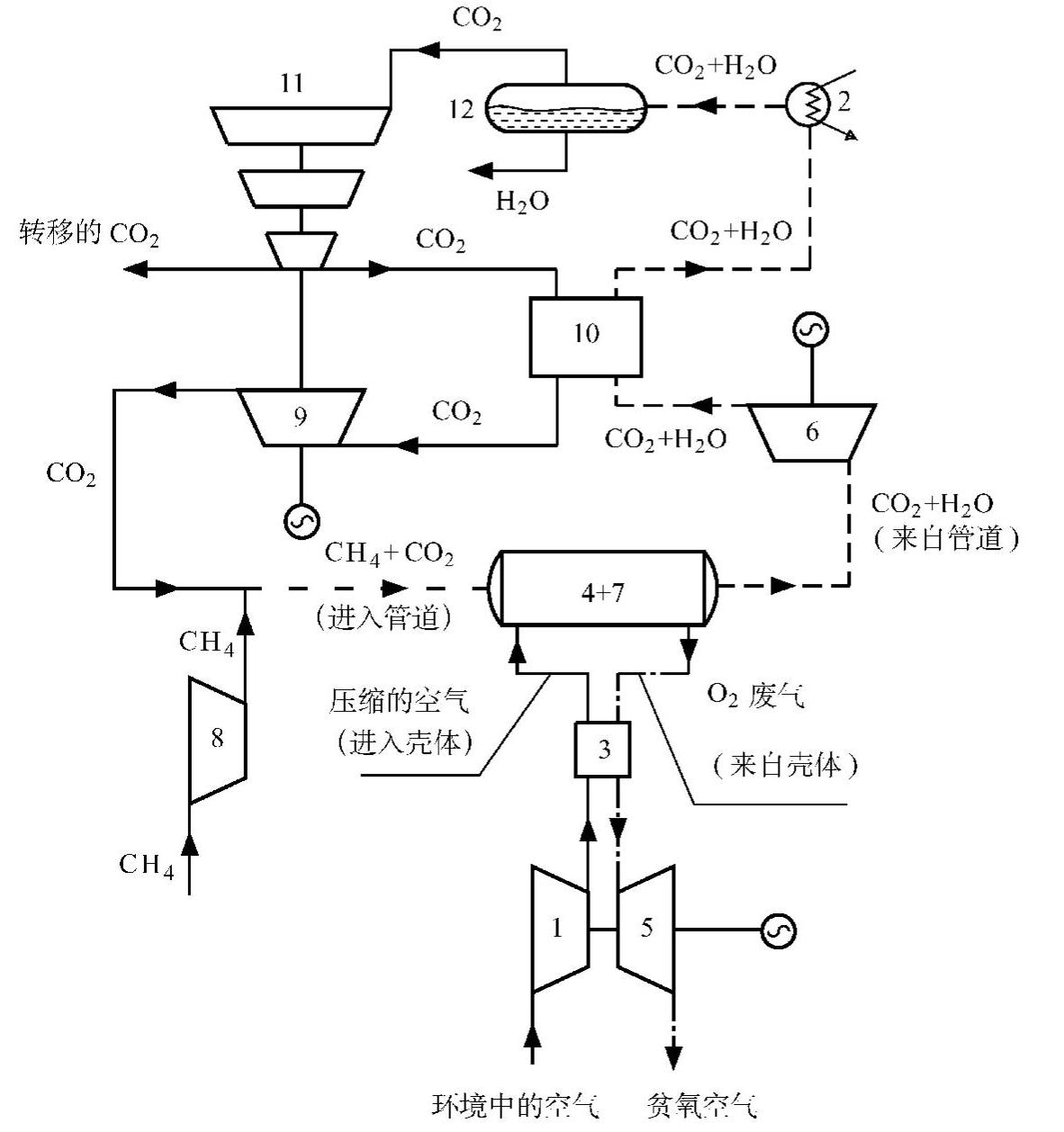
图5-3 将ITM反应器与燃烧室集成到一起的ZEITMOP循环
1—空气压缩机 2—冷却塔 3—热交换器 4+7—ITM燃烧室 5—贫氧燃气轮机 6—CO2+H2O透平 8—CH4压缩机 9—CO2透平 10—再热器 11—具有中间冷却的CO2压缩机 12—水分离器
关于陶瓷膜材料的选择和对氧通量的估算,采用了tenElshof(1997)详细的研究结果。对于ITM燃烧室(即反应器)的配置,使用了有详尽记录并被证实的管壳式燃烧室,如图5-2所示。管子是由有孔难熔的陶瓷(例如氧化铝、Al2O3)做成。混合传导陶瓷膜是被喷洒到底面的孔上。许多这样的薄膜沉积技术很有名,而更多的处于发展中。多孔氧化铝的壁厚为2~3mm,而薄膜的厚度大约为几十微米。图5-3所示的是带ITM燃烧室的零排放电厂的结构示意图。
空气进入压缩机1和热交换器3,达到要求的压力和温度之后进入燃烧室4+7的管(进料)侧。在损失一些氧气并且用来自管侧的热量加热到一个更高的温度之后,贫氧空气流通过热交换器3和燃气轮机5,驱动空气压缩机。贫氧空气排入大气,由于它不含有任何污染物,因而不会对环境造成任何伤害。
在涂膜管内,从8来的燃料气体和再循环的CO2的混合气流都达到了规定的压力和温度,从左侧进入吸收氧流通过管壁。在管壁表面的周围,混合氧和甲烷燃料发生反应,提高气体温度。在ITM燃烧室的右手侧,区别于一个普通的燃烧室,燃烧产物CO2和H2O比入口处的温度更高。甲烷的化学能转化为燃烧产物的热能(内部的)。燃烧产物在透平6中膨胀做功,然后在再热器10中释放热量,再进入冷却塔13,在12中把水从CO2中分离出去。几乎纯净的CO2在多级内冷式压缩机11中被压缩。大部分在再热器10中加热,在透平9中膨胀,剩下的少部分驱动CO2压缩机。膨胀后的CO2处于要求的压力和温度范围内,因此可以和燃料气体混合进入燃烧室。三个轴的电气设备是同步发电机,它能在电动机处于起动和瞬态情况下工作。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




