每种气体都有自己的特征红外吸收频率,例如,在2~14μm范围内,CO2有2.78μm、4.28μm、14.3μm三个吸收峰;CO的吸收峰在4.65μm处;SO2有4.0μm和7.35μm两个吸收峰;甲烷吸收峰在3.31μm处。物质对红外光能量的吸收程度除了与光在物质中经过的路程有关外,还和物质的浓度有关,它们之间的关系符合朗伯-比尔定律。
特征频率并非一个单一频率的光线,它是由一定频率范围内的光组成的。也就是说,特征吸收频率是有带宽的。带宽范围内的各个频率被吸收的程度也是不一样的,计算红外光穿过气体被吸收的能量,需要计算带内各个频率光线被吸收能量的总和[66,72-74]。为了方便计算吸收能量的总和,因而建立了各种吸收模型。
红外光谱定量分析是通过对特征吸收谱带光强被吸收程度来测量组分含量的。由于红外光谱的谱带很多,选择余地大,所以能方便地对某一组分进行定量分析。红外光谱法不受样品状态的限制,能对气体、液体和固体实现定量检测。因此,红外光谱定量分析应用广泛。研究红外光谱能量的吸收采用朗伯-比尔定律,它是由朗伯定律和比尔定律合并而成的,它们在不同方面对吸收定律进行了概括。
朗伯于1760年阐明了光的吸收程度和吸收层厚度的关系,比尔于1852年又提出了光的吸收程度和吸收物质浓度之间也具有类似的关系,两者的结合称为朗伯-比尔定律[65-67,73]。
朗伯定律为
式中 A——溶液的吸光度;
Io——入射光强;
It——出射光强;
K1——被测气体的吸收截面系数(cm2/g),是波长λ的函数;
b——液层厚度,即光程。
当波长为的λ入射光,吸光物质浓度C一定时,溶液的吸光度A与液层厚度b成正比。它描述了吸收度与红外光在吸光物质中穿过的路程之间的关系。比尔定律为
式中 K2——被测气体的吸收截面系数(cm2/g),是波长λ的函数;(https://www.xing528.com)
C——物质浓度。
当波长为的λ入射光,液层厚度b一定时,溶液的吸光度A与吸光物质浓度C成正比。它描述了红外光吸收度与吸收物质浓度C之间的关系,吸光物质浓度越大,红外光被吸收能量也越大。
由以上两定律合并称为朗伯-比尔定律,它表示了红外吸光度与吸收物质浓度、红外在吸收物质中传输的路程之间呈正比关系。朗伯-比尔定律为
朗伯-比尔定律是吸光光度法的理论基础和定量测定的依据。此定律广泛应用于紫外光、可见光、红外光区的吸收测量,不仅适用于气体,也适用于其他均匀的、非色散的吸光物质,包括溶液和固体。但应用该定律也有一定的局限性,事实上,该定律只对单一频率的红外光才适用。因此,在实际应用需加上滤光片,使红外光线的频率尽量限制在一个窄的范围内。但是落于探测器上的辐射也不完全是单色的,这就引起了一定的偏差。另一方面,除了待测物质要吸收红外能量外,组成红外传感器的光学元件也要吸收或者反射能量,引起测量的误差。因此,在实际计算过程中,需要对该定律进行修正。
当一束平行单色光通过均匀、透明的吸光介质时,其吸光度与吸光质点的浓度和吸收层厚度的乘积成正比。透光率(透射比)T之间的关系如下:

吸光度A与入射光、透过光、物质浓度和光程之间的关系如下,见式(2-6)和式(2-7)及图2-8。
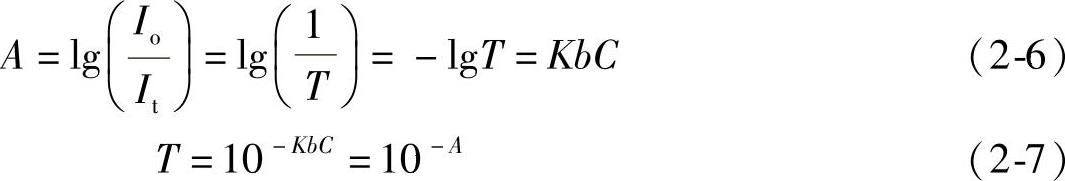
上面描述了红外吸收的基本定律,阐述了介质浓度(包括溶液、气体等物质)与透射比、吸光度之间的相互关系。这些关系对于基于这一性质的应用开发提供了重大的基础理论依据,大多应用都是基于这一性质来开发实现的。下面阐述这些性质及理论在气体检测领域中的应用方法。事实上对于气体、溶液等基本都是一样的,只是介质的本身不一样而已,在设计原理及方法等都是相似的。
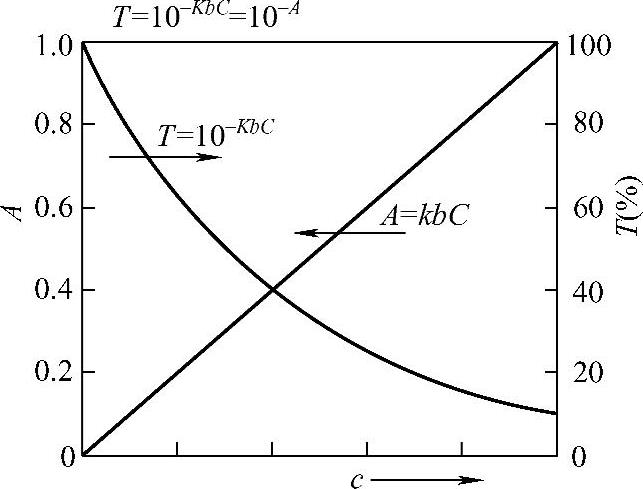
图2-8 吸光度A、透射比T与浓度C的关系
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




