纯铁具有两种同素异形结构:体心立方体α—Fe、δ—Fe和面心立方体γ—Fe。在910℃以下时,纯铁呈α—Fe存在。在910℃时,体心立方晶格的α—Fe转变为面心立方晶格的γ—Fe,而γ—Fe在1400℃时又重新转变为体心立方晶格的α—Fe。不过,高温的α—Fe通常叫做δ—Fe。纯铁的物理性能和热力学数据见表3-1。下面讨论纯铁的热力学数据。
图3-1示出了纯铁比热与温度的关系,表3-1给出了具体的数值。一般来说,物质的比热随温度的升高而增高,这也就是说,当温度升高时,需要更多的热量才能使单位质量的物质升温1℃。比热与温度的关系可以用式(3-1)表示:
![]()
式中 CP——等压比热(cal[1]/mol);T——绝对温度;
a、b、c、d——系数。
又知等压比热可用式(3-2)计算:
![]()
式中 CV——等容比热(cal/mol);
R——气体常数,R=1.987cal/mol。
纯铁发生的物理—化学过程,一般都是在恒压下进行的,所以应以CP 进行计算。但是另一方面,纯铁在固态和液态随温度而发生的体积变化又是很小的(dv≌0,dv为体积变化,以微分表示),因此,可以近似地认为CP≌CV。然而要指出的是,当温度非常高时,就会出现很大的偏差,因而CP≠CV。
由图3-1可以看出,在绝对温度为零度时,纯铁的CP值为零。随着温度升高,CP 值呈曲线增加,升温到760℃时达18cal/mol。在760℃ (居里点)时,α—Fe失去铁磁性。用虚线表示α—Fe到δ—Fe之间的过渡和它们之间的同一性。曲线的不连续性是与发生转变过程有关,而这都与晶格结构发生改变相联系。

图3-1 纯铁比热随温度的变化
表3-1 纯铁的物理性能和热力学数据
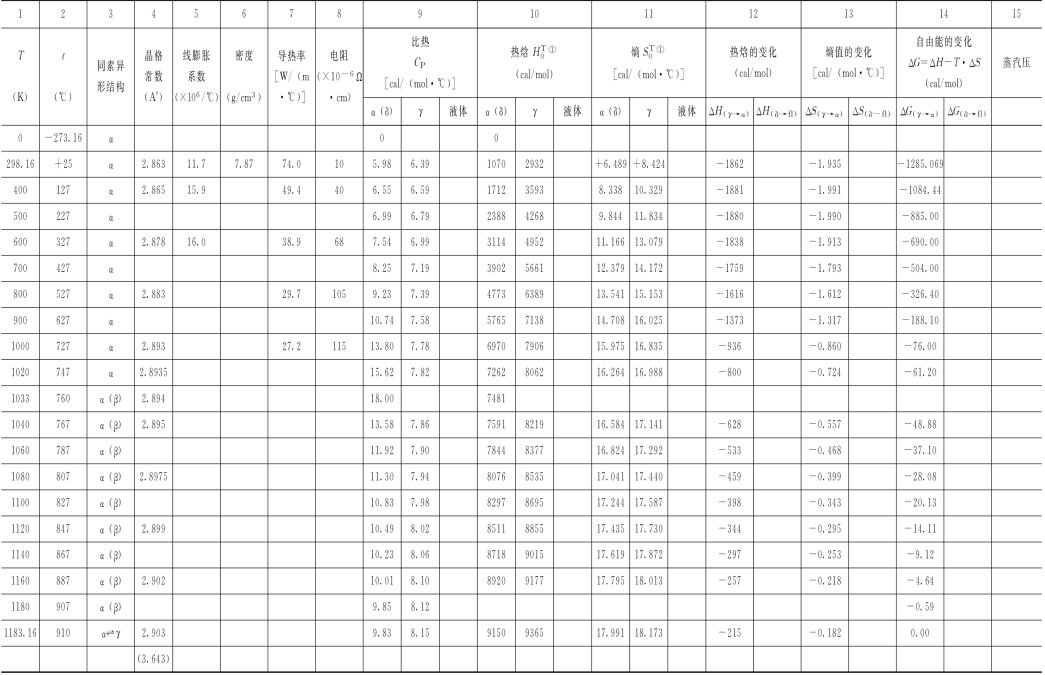
续表
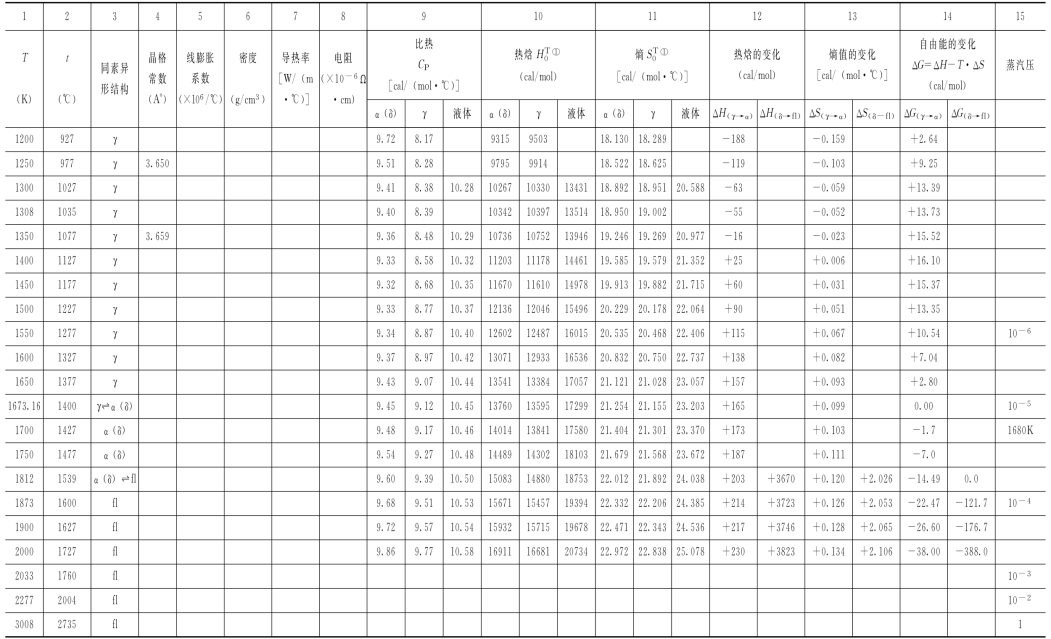
注表中12、13、14中的“fl ”指液体。
①取α—Fe 在绝对零点时的H0 *值为零。

图3-2 纯铁的热焓随温度的变化
根据热力学第一定律和热焓H的定义有式(3-3):
![]()
由式(3-3)计算的纯铁热焓H0T 从绝对零度到绝对温度为2000K之间随温度变化的曲线关系示于图3 2。由于热焓没有绝对的度量值,所以必须建立初始点。正如图3-2所示,假定认为H0* (*指标准态,这里指的是纯铁,而且是指固态α—Fe;0指初始温度,这里指的是0K)等于零。由于在低温时测量热量值是很困难的,所以常常选择初始温度为298.16K=25℃。初始点的选择是任意的,但重要的是,在进行热力学计算时,必须选用相同的初始数据。
由图3-2得知,在曲线表示的转变点处有飞跃,这是因为任何一种同素异形转变均与能量发生变化相关,这些能量变化有相变热、熔化潜热、汽化热、升华热等。在计算热焓时,必须考虑这些参数。因此,铁液从零度到T温度的热焓用式(3-4)计算:

用式(3-4)计算得出的数据示于表3-1中的第10项。(https://www.xing528.com)
由热力学第二定律得式(3-5):
![]()
式中 ΔG*——标准态自由能的变化;
R——气体常数;
T——绝对温度;
K——平衡常数。
由热力学第二定律得式(3-6):
![]()
式中 ΔH*——标准态下的热焓变化;
ΔS*——标准态下的熵值变化。
对于纯铁来说,α—Fe和δ—Fe在1183K以下和在1673~1812K时的自由能要比γ—Fe的自由能小,而γ—Fe在1183~1673K时,则具有最小的自由能数值。表3-1中的第14项和在图3-3中示出了ΔG*值随温度的变化,该曲线在1183K和1673K两次通过零点。在这些零点处,ΔG*=0,这也就是说,此时转变处于平衡状态。
将式(3-5)代入式(3-6)中得式(3-7):


令:

所以,

或:

由此,可以确定ΔH*和ΔS*。
如果用试验方法求出K 值与温度的关系,由此就可以确定ΔH*和ΔS*值。另外,如果ΔH*和ΔS*值为已知时,就可计算K值。
表3-1中除了纯铁的物理性能 (同素异形结构、晶格常数、线膨胀系数、密度、导热率和比热等)外,还给出了纯铁的热力学数据,其中包括热焓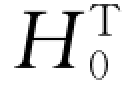 、熵
、熵 及ΔH、ΔS值随温度的变化。
及ΔH、ΔS值随温度的变化。

图3-3 α—Fe(δ—Fe)和δ—Fe的自由能随温度的变化
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




