1.基层建立之前
当挥发皿中加入水+锌粉时,溶液中几乎没有化学变化,锌粉下沉并堆积在挥发皿的底部,玻璃棒搅拌后锌粉则均匀分布在挥发皿底部,没有发生团聚现象,如图2-2所示。对于金属而言,它是由带正电荷的离子和电子构成的晶体。机械镀锌此阶段中镀液浆料的溶剂是水,水是一种极性分子,所以当基体(Fe)、锌粉颗粒(Zn)等负电性金属浸在镀液中时,存在下列情况:金属表面的金属正离子在水极性分子的作用下发生水合(见图2-3),水合时足以克服晶体中金属正离子与电子的引力,则金属表面上的一些正离子会脱离金属而进入溶液成为水合离子,一方面使金属表面积累了过剩的电子,使金属带负电,另一方面则使紧靠金属表面的液层带正电。这样在基体金属与镀液的界面及锌粉颗粒与镀液的界面上形成了双电层(见图2-4)。形成双电层以后,由于静电引力的作用,带负电的金属又吸引溶液中的水合正离子,此过程与前一过程相反。当两种过程的速率相等时,就会建立起如下的动态平衡:Men+·ne+mH2O Men+·mH2O+ne。
Men+·mH2O+ne。

图2-2 锌粉在水中
a)搅拌前 b)搅拌后
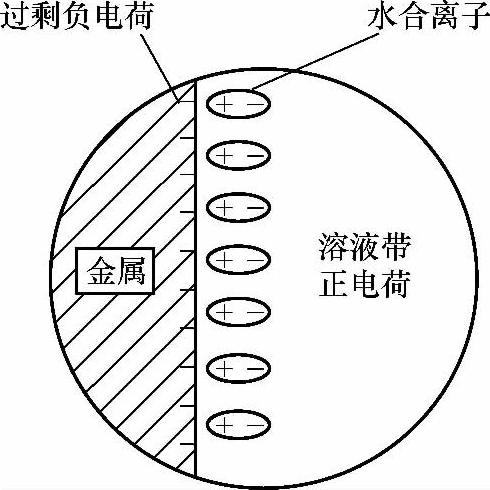
图2-3 水极性分子对溶液中金属离子的作用
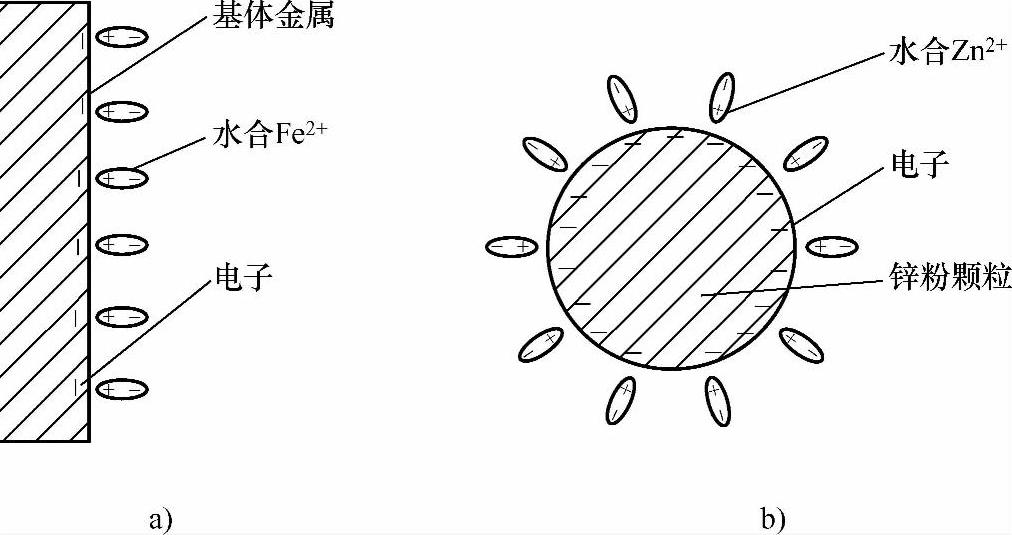
图2-4 基体、锌粉颗粒在镀液中的双电层
a)基体 b)锌粉颗粒
锌粉颗粒表面Zeta电位(剪切面的电位,又叫电动电位)等于零,锌粉颗粒表面的双电层表现为最小斥力[1],从而促使颗粒团聚;但由于原始锌粉颗粒表面含有氧化物等污物,且颗粒受到的重力远大于颗粒间的吸引力,所以锌粉颗粒分散在挥发皿的底部。然后向挥发皿中滴加硫酸溶液调整pH值为1~2,随着硫酸的加入,挥发皿中的锌粉组成一层薄膜状锌层从挥发皿底部慢慢浮起(见图2-5),溶液中伴有气泡产生,有的气泡附着在锌粉层表面,有的气泡上浮溢出液面,溢出气体带有刺激性气味。这是因为随着溶液中H+的加入,基体表面、锌粉颗粒表面的双电层结构发生了变化(见图2-6、图2-7)。

图2-5 锌粉+水+工件+H2SO4
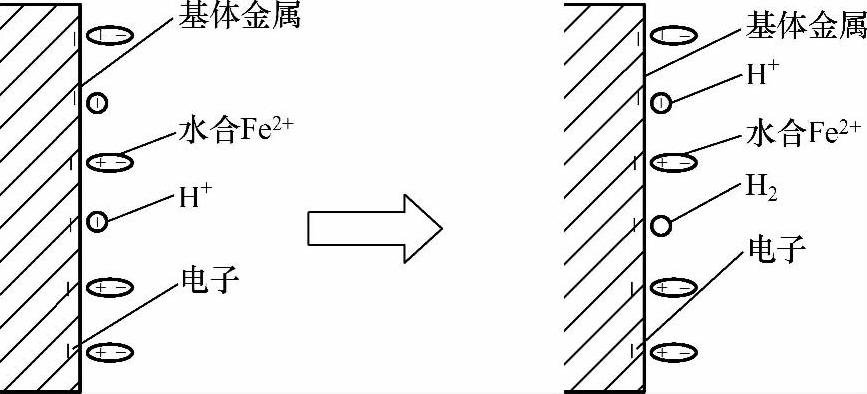
图2-6 H2O+H2SO4中基体(Fe)表面的双电层
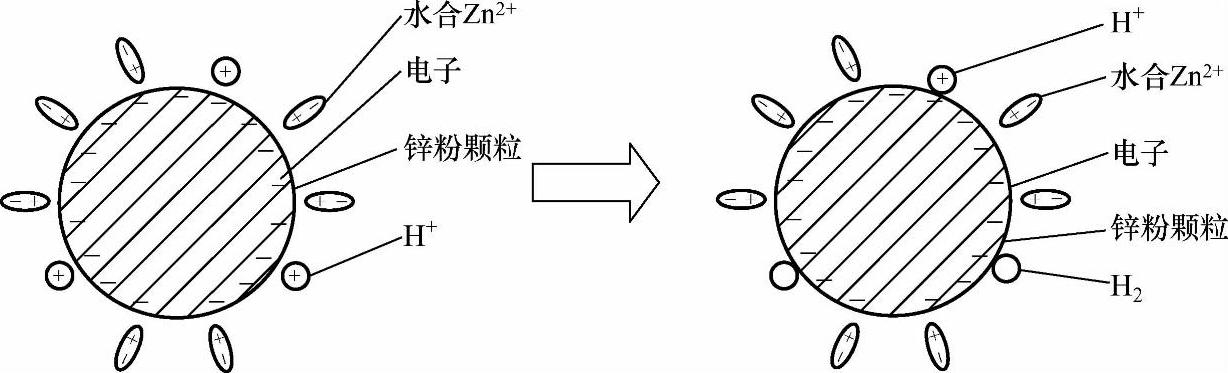
图2-7 H2O+H2SO4中锌粉颗粒(Zn)表面的双电层
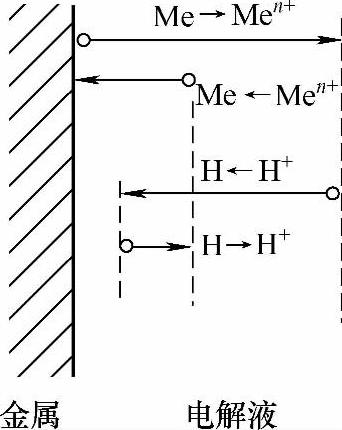
图2-8 稳定的电极电位示意图
双电层结构的变化使得电极电位趋于非平衡电极电位,但在较短的时间内(几分钟内),电子从金属迁移到溶液和从溶液迁移到金属的速率相等,即建立起电荷平衡,此时非平衡电极电位就能稳定[2]。如图2-8所示,自左至右和自右至左迁移的电荷数量相等,但向右进入溶液的金属离子的量大于金属还原为金属的量。因为在这种情况下,除了一对反应Me→Men+和Me←Men+外,同时还进行着另一对电极过程H→H+和H←H+。显然,此时可以建立电荷平衡,即从金属迁移至溶液和从溶液迁移至金属的电荷数相等。但由于金属离子迁移入溶液,而留在金属上的电子不仅为该金属离子向反方向迁移所抵消,同时还有H+从溶液向金属迁移的抵消作用,所以对金属离子Men+而言,此时已不再维持物质平衡状态,基体金属(Fe)和锌粉颗粒(Zn)表面均存在此种情况(见图2-9、图2-10)。
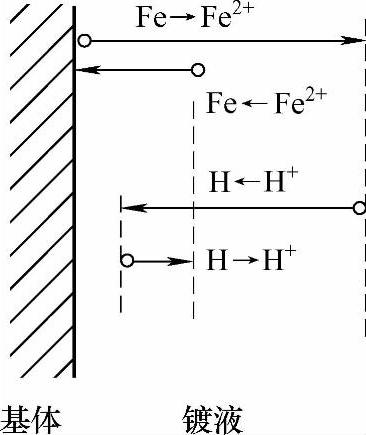
图2-9 基体表面的电极电位示意图
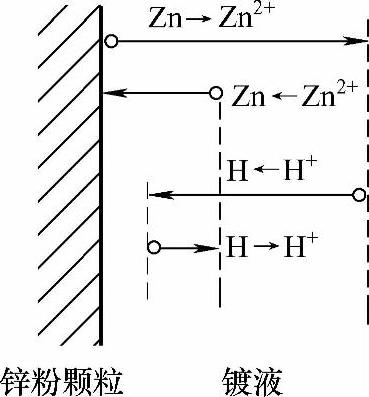
图2-10 锌粉颗粒表面的电极电位示意图
玻璃棒搅拌后发现原来松散的锌粉颗粒团聚成藻团状(见图2-11),藻团状的锌粉并没有在工件表面发生吸附、沉积(见图2-12)。气体的产生是因为发生了如下反应:2H++2e→H2↑。氢气部分吸附在锌粉颗粒表面,因为气泡的聚合造成锌粉颗粒的团聚,部分气泡聚合到一定的体积便溢出液面。这正是我们观察到的挥发皿中不断有刺激性气味气体溢出的原因。
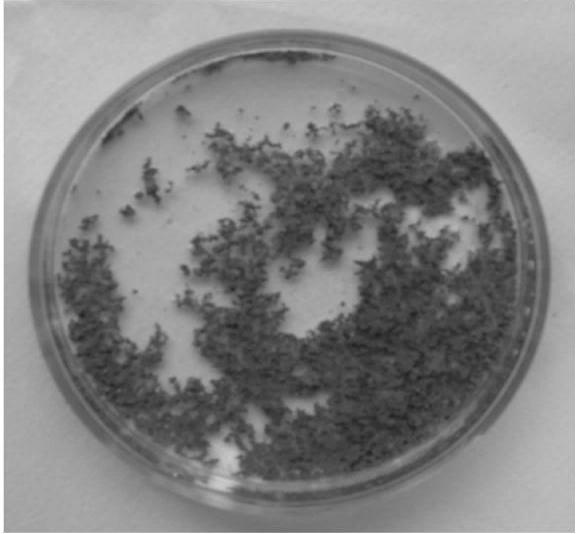
图2-11 锌粉+水+硫酸

图2-12 锌粉+水+工件+硫酸
因此,在基层建立之前,镀液中主要发生如下反应:(https://www.xing528.com)
Fe+2H+→Fe2++H2↑ (2-5)
Zn+2H+→Zn2++H2↑ (2-6)
活性锌粉颗粒的添加并将使反应式(2-6)抑制反应式(2-5)的进行,结果导致镀液中Zn2+浓度增加,而Fe2+浓度增加缓慢甚至降低。这一结论已被表2-2中1#、2#检测结果所验证。
2.基层建立中
挥发皿中加入水+锌粉+工件+硫酸后,添加含有SnSO4的溶液。随着SnSO4的加入,镀液中工件(铁)表面、锌粉颗粒表面的双电层结构及电极电位发生了变化(见图2-13、图2-14),导致锌粉颗粒表面、工件(铁基)表面的电极电位更加远离平衡电极电位(见图2-15、图2-16)。
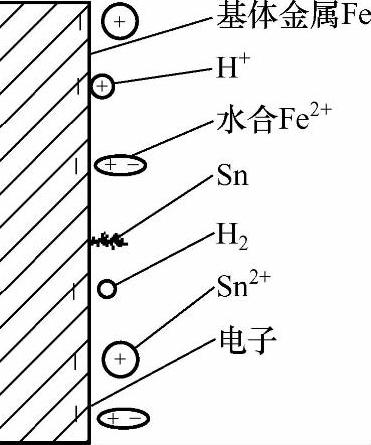
图2-13 添加SnSO4后基体(Fe)表面的双电层
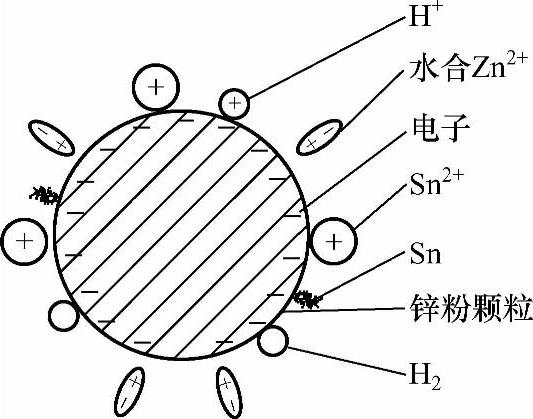
图2-14 添加SnSO4后锌粉颗粒(Zn)表面的双电层
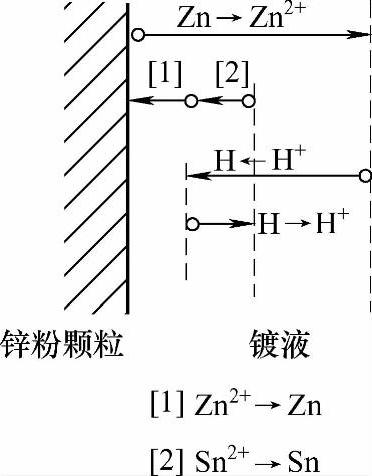
图2-15 添加SnSO4后锌粉颗粒表面电极电位示意图
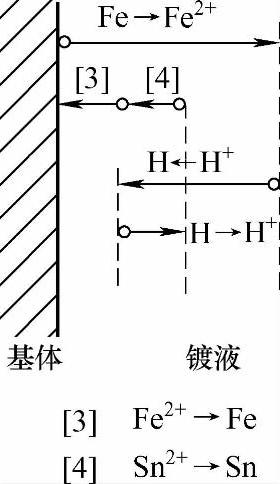
图2-16 添加SnSO4后基体表面电极电位示意图
试验中发现在锌粉藻团周围有银白色锡枝状晶析出(见图2-17),这也被镀层结构、成分分析时的XRD、EDS、XRF的分析结果所证实(参见第3章)。锌粉藻团逐渐向工件移动,并最终吸附在工件表面上,此过程一直有氢气泡溢出。将正在移动的锌粉藻团用玻璃棒拖回,发现此锌粉藻团仍会再次向工件移动。几分钟后,几乎所有的锌粉藻团都吸附在工件表面上,如图2-18所示。
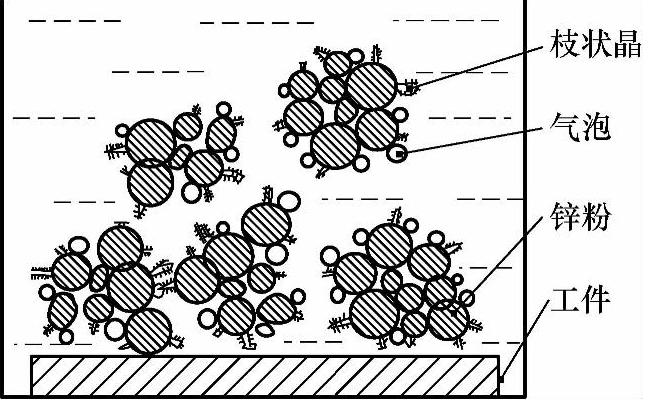
图2-17 基层建立阶段的枝状晶体示意图

图2-18 金属锌粉在工件表面沉积的光学相机照片
基层建立阶段镀液中存在Fe、Zn、Sn、Sn2+、H+、Fe2+、H2、Zn2+,据能斯特方程,相关电极电势计算结果为:EZn2+/Zn0=-0.816V,ESn2+/Sn0=-0.179V,-0.440V<EFe2+/Fe0<0,EH+/H2=-0.089V。此阶段镀液的pH值为1~2,镀液呈酸性,镀液中的基体和锌粉颗粒一直发生着自溶解,同时析出氢气,所以化学反应式(2-5)和式(2-6)一直进行着,导致镀液中Fe2+、Zn2+的浓度增加,这一结论也被表2-2中3#、4#化验结果所验证。因为锌的负电性比铁的负电性更负,镀液中更容易出现Zn2+,基体表面过剩的负电荷除了吸引H+,也开始吸引Zn2+,发生Zn2+→Zn反应。锌粉颗粒表面的过剩负电荷更多,更容易吸附H+,所以锌粉的存在影响了Fe与H+的反应,使式(2-5)反应强度变弱,削弱了Fe2+→Fe过程,反应式(2-6)的ΔG要远小于反应式(2-5)的ΔG。因此,式(2-6)过程更容易发生,导致镀液中锌离子的浓度快速增加。
镀液中刚刚加入锡盐后镀液中Sn2+的浓度很高(见表2-2中3#),虽然镀液中的Zn相对于Sn2+是绝对过量的,但式(2-7)反应进行到Zn、Sn的电化学可逆电位相等时达到动态平衡,经电化学平衡计算得,αSn2+/αZn2+=10-21(αSn2+、αZn2分别视为平衡时Sn2+和Zn2+在镀液中的浓度)。从计算结果可以得出,只要有足够量的锌粉完全可以将镀液中的Sn2+还原成金属锡。另外,按文献[3]提出的理论,镀液环境中反应式(2-7)置换体系的电位差ΔE=0.637V>0.36V,则反应式(2-7)置换过程受扩散控制。但是,机械镀锌设备镀筒的360°圆周旋转和20°~60°上下翻转可完全消除扩散因素的影响。而在实际生产中基层建立时加入的锌粉量由待镀工件的总表面积决定,且在Sn2+还原的同时还会引起锌粉和锡在工件表面的共同沉积[4]。因此,机械镀锌过程没有足够量的锌粉将Sn2+完全还原为金属锡,随着式(2-7)的不断进行,式(2-8)将开始发生。式(2-7)和式(2-8)反应的结果,造成短时间内(3~5min)镀液中Sn2+的浓度快速下降(对比表2-2中的3#和4#)。
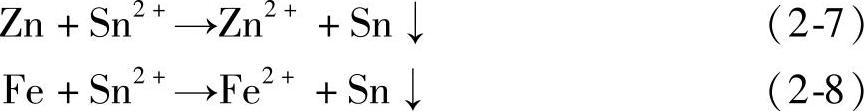
表2-2 不同时间段镀液取样的ICP-AES检测结果
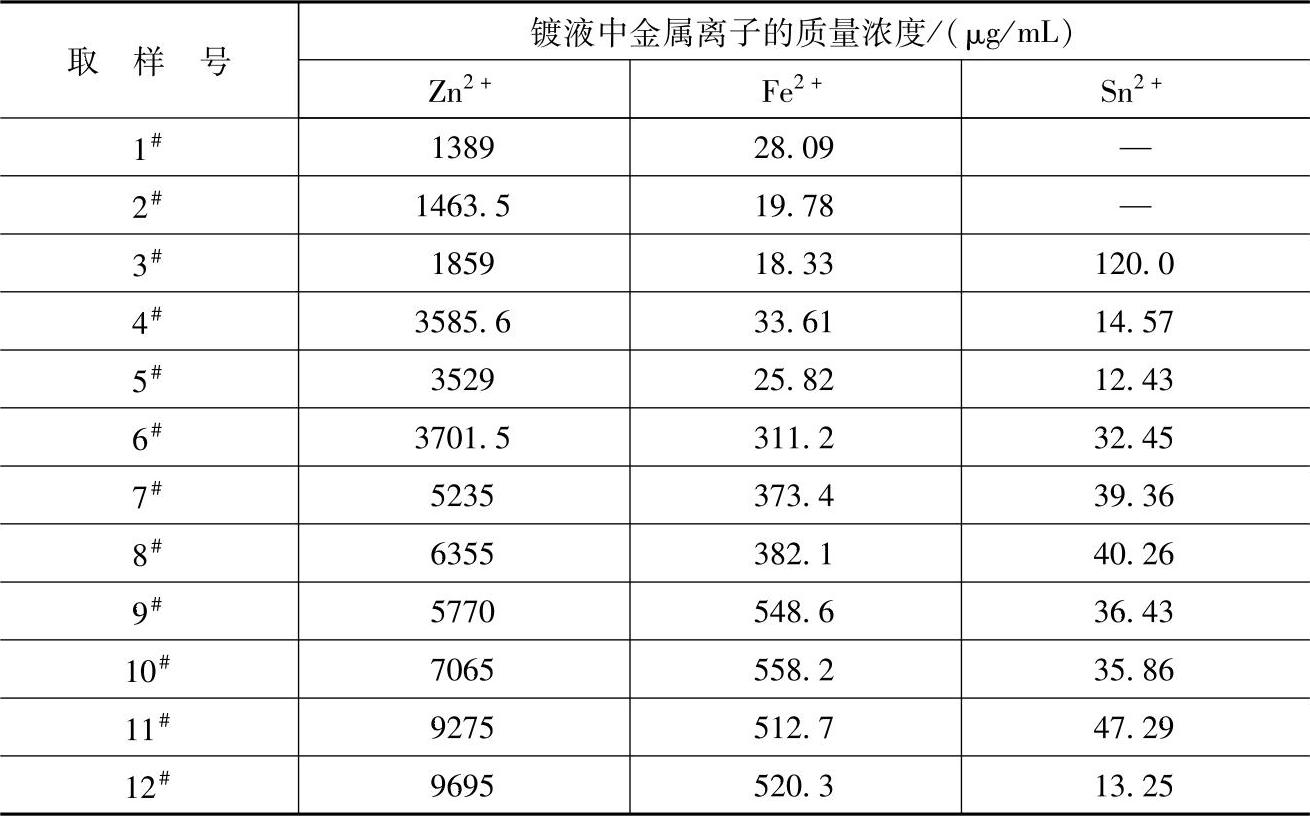
反应式(2-7)是一置换反应,在镀液环境中以无数微原电池的形式存在。根据电极反应动力学的现代理论,在任何与电解质相接触的金属表面上,进行着共轭的阴极和阳极的电化学反应,且金属表面上阴极区和阳极区在空间上的不分离反应可照样进行[5]。在微原电池中,锌粉颗粒表面并非等电位。这是因为锌粉颗粒表面存在凸峰、凹坑、平台等表面缺陷(见图2-19),致使锌粉颗粒表面在酸性镀液中表现出不同的电极电位。在微原电池反应中,产物Sn首先沉积在锌粉颗粒的凸峰等缺陷位置,即锌粉颗粒表面的一部分被置换的Sn所覆盖成为阴极区段,且这部分变为惰性;但镀筒的转动和冲击介质的碰撞总可以使Sn2+绕锌粉颗粒运动,并最终在其他活性点位置置换沉积。同时,锌粉颗粒表面的其他缺陷位置处发生金属锌的氧化成为原电池的阳极区段,发生Zn的离子化,而电子则在金属锌颗粒内由阳极区段流向阴极区段(见图2-20)。反应式(2-7)的产物Sn晶体以非均质形核的方式呈树枝状析出,并依附围绕在锌粉颗粒的周围。式(2-6)、式(2-7)、式(2-8)反应的结果,使得锌粉颗粒表面呈弱正电性,工件表面呈弱负电性,造成锌粉颗粒表面和工件表面之间产生库仑引力,促使锌粉沉积到工件表面上。
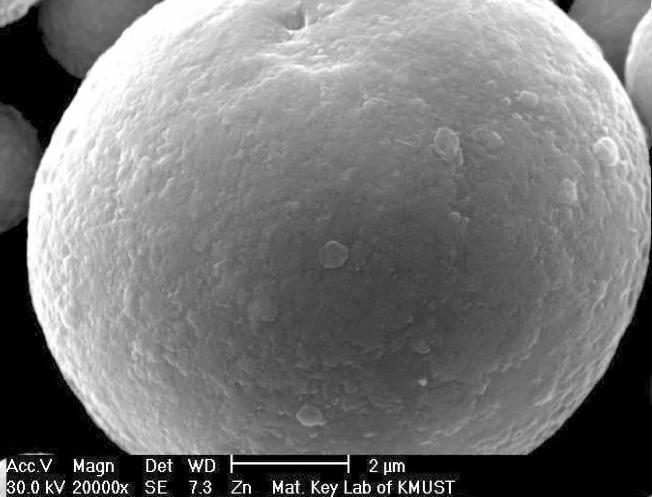
图2-19 金属锌粉的表面形貌
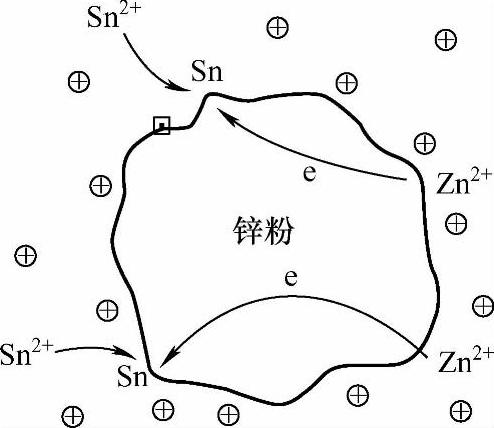
图2-20 锌粉颗粒表面的微原电池示意图
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




