生物组织中的天然色素由活细胞合成、积累或分泌而成。此外,食品加工过程也可能导致颜色的形成或转化。生物组织中固有的色素一直是人类普通膳食中的一部分,并且长期被人安全食用。它们的化学结构一般很复杂,并可据此对其进行分类,如表9-1所示。
表9-1 基于化学结构的植物和动物色素分类
血红素是铁卟啉衍生物,可溶于水,主要存在于动物肌肉和血液中。肌红蛋白是一种最主要的色素,在肉类中起着呈色作用。在经正常放血后的肌肉组织中,肌红蛋白所起的呈色作用占90%以上。在不同肌肉组织中,肌红蛋白的数量差异较大,并受品种、育龄、性别及活动程度的影响。例如淡色的小菜牛肉中肌红蛋白的含量较红色牛肉低。在同一动物体内不同肌肉间的差异也很明显,这些差异由肌肉纤维中所含肌红蛋白数量不同所致。表9-2所示为发现于新鲜、腌制及熟肉中的主要色素。肌肉组织中尚有少量其他色素,例如细胞色素酶、黄酮及维生素B12。
表9-2 存在于新鲜肉、腌肉和熟肉中的主要色素
(一)肌红蛋白与血红蛋白
1.血红素化合物的结构
肌红蛋白为单条多肽链组成的球状蛋白质,分子质量为16.8ku,由153个氨基酸组成,其蛋白质部分为球蛋白。其中的卟啉环具有光吸收和显色的发色团,卟啉环由四个吡咯环连接在一起,并连接至中央的铁原子,因而肌红蛋白是由球蛋白和血红素组成的复合体(图9-2)。卟啉环存在于球蛋白的疏水区域内,并与组氨酸残基相连(图9-3)。位居中央的铁原子具有6个配位部位,其中四个分别被4个吡咯环上的氮原子占据,第五个则与球蛋白的组氨酸残基键合,剩余的第六个配位部位可络合各种电负性原子。
血红蛋白是由4个肌红蛋白组成的四聚体,它可作为血红细胞的一个组分在肺中与氧形成可逆的络合物。该络合物经血液输送至动物全身各组织,氧则在该处被组织吸收。能与分子氧结合的基团即血红蛋白,细胞组织中的肌红蛋白起类似作用,它可接受血红蛋白运送的氧。因而肌红蛋白可在组织内贮存氧,以供代谢利用。
图9-2 血红色素的化学结构
图9-3 肌红蛋白的三级结构
2.化学与颜色:氧化态
肉的颜色取决于肌红蛋白的化学性质、其氧化态、与血红蛋白键合的配体类型以及球蛋白的状态。卟啉环中的血红蛋白铁能以两种形式存在:还原型亚铁离子(+2)或氧化型高铁离子(+3)。血红素中铁原子的氧化态应与肌红蛋白的氧合态有所区别。当分子氧与肌红蛋白结合后,形成氧合肌红蛋白(MbO2),这一作用称为氧合。当肌红蛋白发生氧化反应,铁原子被转化为高价态铁(+3),即形成了高铁肌红蛋白(MMb)。当血红蛋白中的铁离子处于+2价(亚铁)并且缺乏配体键合所需的第六个部位时,它被称为肌红蛋白。
含有肌红蛋白(亦称作脱氧肌红蛋白)的肉类组织显紫红色。当分子氧结合于第六个配体位置时,形成了氧合肌红蛋白(MbO2),肉组织的颜色可变为通常的亮红色。紫红色的肌红蛋白和红色的氧合肌红蛋白都能被氧化,此时亚铁变为高铁。若经自动氧化机制,两者都可转变为所不期望的高铁肌红蛋白(MMb),后者显红棕色。此时,高铁肌红蛋白不再与氧结合,第六个配体位置被水占据。
肉类中高铁肌红蛋白(MMb)能通过酶促或非酶作用,被还原成肌红蛋白(Mb)形式,其中主要的途径可能是高铁肌红蛋白(MMb)还原酶的酶促作用。此酶在有NADH时能高效将高铁肌红蛋白中高铁还原至亚铁态。图9-4所示为亚铁血红色素的各类反应。新鲜肉中颜色反应呈动态变化,并取决于肌肉状态以及高铁肌红蛋白、肌红蛋白和氧合肌红蛋白间的比例。高铁肌红蛋白和氧合肌红蛋白之间的相互转化,取决于氧分压值。而高铁肌红蛋白向其他形式产物的转化,则需要酶促或非酶反应将高铁还原至亚铁。
图9-4 新鲜肉和腌肉中肌红蛋白的反应
NMMb和NMb为亚硝酸与分子中血红素部分的反应产物
氧分压与各类血红蛋白色素百分数之间的关系如图9-5所示。高氧分压有利于氧合,形成亮红色的氧合肌红蛋白。与此相反,在低氧分压时,有利于形成肌红蛋白和高铁肌红蛋白。为了促进氧合肌红蛋白的形成,可使环境中的氧处于饱和状态。若氧被完全排除,则使血红蛋白氧化(Fe2+→Fe3+)引起的高铁肌红蛋白形成的速率降至最小程度,肌肉中各种色素的比例随所处氧分压的不同而异。
球蛋白可降低血红素氧化的速率(Fe2+→Fe3+)。此外,在低pH时氧化反应进行较快,氧合肌红蛋白的自动氧化反应速度比肌红蛋白低。痕量金属尤其是铜离子的存在可促进自动氧化反应。
3.化学与颜色:变色反应
有两种不同的反应可使肌红蛋白变为绿色。一是过氧化氢可与血红素蛋白中的亚铁或高铁反应,生成胆绿蛋白,即一种绿色素。二是在有硫化氢和氧存在时,可形成绿色的硫代肌红蛋白。通常认为过氧化氢或/及硫化氢是由细菌生长所致,产生绿色素的第三个机制发生于腌肉中。
图9-5 氧分压对肌红蛋白三种化学状态的影响
(二)腌制肉色素
在大部分腌肉制作过程中,可加入硝酸盐和亚硝酸盐以促进颜色和风味,并可抑制肉毒梭菌。腌肉制品保持稳定粉红色的主要原因是在此过程中发生的一些特殊反应。图9-4简要描述了这些反应,影响反应的化合物见表9-2。
第一个化学反应发生于氧化氮(NO)与肌红蛋白间,生成氧化氮肌红蛋白(MbNO),也称为亚硝基肌红蛋白。MbNO显鲜红色且不稳定,受热后形成较稳定的氧化氮肌血色原(亚硝基血色素),此产物可生成腌肉所期望的粉红色。该色素在受热时其球蛋白部分变性,但粉红色继续保留。当有高铁肌红蛋白存在时,在与氧化氮物反应前,需要用还原剂将高铁肌红蛋白转化为肌红蛋白。反应的另一种机制是,亚硝酸盐可与高铁肌红蛋白直接相互作用。当存在过量亚硝酸时,可形成硝基肌红蛋白(NMb)。NMb在还原性条件下受热时,易转化为绿色的硝化氯化血红素。该系列反应会导致众所周知的“亚硝酸盐灼烧”缺陷。
在无氧状态下,肌红蛋白氧化氮复合物相当稳定。然而,这类色素在有氧条件下,对光非常敏感。若加入抗坏血酸或巯基化合物等还原剂,可将亚硝酸盐还原为一氧化氮。在此条件下,更容易形成氧化氮肌红蛋白。
帕尔玛火腿是一种仅用猪肉和盐在不加硝酸盐和亚硝酸盐的情况下制成的火腿的特殊类型。这些产品在干燥腌制过程中会产生一种新的色素—锌卟啉,血红素中铁原子被锌原子所替代。这些色素是帕尔玛火腿稳定亮红色的主要因素。
(三)肉类色素的稳定性
决定消费者对肉类可接受性的主要因素是肌肉的颜色,在复杂食品体系中的许多因素可影响肉类色素的稳定性。此外,这些因素之间的相互作用非常关键,并且难以确定其中的因果关系。某些外界条件如光照、温度、相对湿度、pH和特定细菌的存在,均可对肉类颜色和色素的稳定性产生重要影响。
某些特定反应如脂肪氧化反应可增加色素氧化速率,而加入某些抗氧化剂如抗坏血酸、维生素E、丁基羟基茴香醚(BHA)或没食子酸丙酯(PG),也可改善颜色的稳定性。菜牛食品中添加维生素E补充剂,可有效提高肉制品中颜色稳定性。
对肉类的辐照亦可造成其颜色变化,这是由于肌红蛋白分子(尤其是其中的铁)对化学环境变化和能量输入很敏感。在辐照过程中,原本稳定的红色素、棕色素甚至绿色素都可能褪色。在屠宰家畜前饲喂抗氧化剂,优化肉类辐照前的条件,添加抗氧化剂,采用气调包装(MAP)并控制温度,或综合运用各类技术手段都可能有助于优化辐射过程中的颜色。
(四)包装的影响
稳定肉类色泽的一个重要手段是将其保藏于合适的条件下。气调包装能够延长肉制品的货架期,经低透气性的薄膜包装后,将空气从包装中排出以及贮藏气体的注入可减少血红蛋白氧化(Fe2+→Fe3+)导致的褪色。注入富氧或无氧气体,也可提高色泽稳定性。将肌肉组织贮藏于无氧(100%CO2)条件下或存在氧清除剂时均显示良好的颜色稳定性。
(一)叶绿素及其衍生物的结构
叶绿素是绿色植物、海藻和光合细菌中的主要光合色素,它们是由卟吩衍生出的镁络合物。卟吩具有全共轭不饱和闭合大环结构,由四个吡咯环经单碳桥连接而成。按Fisher编号系统(图9-6),四个环分别编号为Ⅰ至Ⅳ或A至D,卟吩环外围上的吡咯碳分别编号为1至8。桥连碳被分别命名为α、β、γ和δ。卟吩的IUPAC编号系统见图9-6(2),但更常见的编号系统为Fisher法。
带有取代基的卟吩称为卟啉。卟啉是任何一种大环四吡咯类色素,其中吡咯环由亚甲基桥连,而双键系统形成一个闭合共轭环。通常认为脱镁叶绿素母环[图9-6(3)]是所有叶绿素的母核,它由卟吩加上第五个碳环(V)而形成。因而,将叶绿素归类于大环四吡咯色素。
目前自然界中存在数种叶绿素,其结构差别是母环上取代基的种类。叶绿素a和叶绿素b存在于绿色植物中,其比例约为3∶1。它们的区别在于3位碳上的取代基不同,叶绿素a含有一甲基,而叶绿素b则含有一甲醛基[图9-6(4)]。两者在2位碳和4位碳上分别连接乙烯基和乙基,碳环的10位碳上连接甲氧甲酰基,并在7位碳上连接丙酸植醇基。植醇是含有20个碳的具有类异戊二烯结构的单不饱和醇。如图9-6(4)所示,叶绿素c与叶绿素a共存于海藻、腰鞭毛虫及硅藻中。叶绿素d与叶绿素a共存于红藻中,而叶绿素d的含量较低。细菌叶绿素和绿菌叶绿素分别是紫色光合细菌和绿色硫菌中叶绿素的主要叶绿素。叶绿素及其衍生物广泛使用俗名,表9-3所示为最常用的名称。图9-7所示为叶绿素及其一些衍生物相互间结构关系的示意图。
(二)物理性质
叶绿素位于绿色植物细胞间器官的薄层中,也称为叶绿体,它们与类胡萝卜素、脂质和脂蛋白相结合。其非共价键的连接作用很弱,连接键容易断裂,因而可将植物组织置于有机溶剂浸泡从而萃取出叶绿素。丙酮、甲醇、乙醇、乙酸乙酯、嘧啶和二甲基甲酰胺等极性溶剂是叶绿素充分萃取最有效的溶剂,而己烷和石油醚等非极性溶剂则效果较差。
图9-6 卟吩(1)、(2)、脱镁叶绿素母环(3)及叶绿素[chl](4)的结构式
表9-3 叶绿素衍生物的命名
叶绿素a、叶绿素b及其衍生物的可见光谱在600~700nm(红区)及400~500nm(蓝区)有尖锐吸收峰(表9-4)。溶于乙醚中的叶绿素a和叶绿素b的最大吸收波长分别为:红区,660.5nm和642nm;蓝区,428.5nm和452.5nm。
表9-4 叶绿素a和叶绿素b及其衍生物在乙醚中的光谱性质
(三)叶绿素的变化
1.酶促反应
叶绿素酶是已知唯一能促使叶绿素降解的酶。该酯酶可催化植醇从叶绿素及其无镁衍生物(脱镁叶绿素)上解离,分别形成脱植醇叶绿素和脱镁脱植醇叶绿素(图9-7)。当卟啉环10位碳上带有甲氧甲酰基、C-7位和C-8位上带有氢时,酶活力受到限制。该酶在水、乙醇或丙酮类溶液中具有活力,当遇大量醇类物质如甲醇或乙醇时,植醇从叶绿素中解离出来,脱植醇叶绿素可经酯化形成相应的甲醇或乙醇酯。叶绿素酶只有在采后经热激活后,才可在新鲜叶片中形成脱植醇叶绿素。蔬菜中叶绿素酶的最适温度在60~82.2℃,当植物组织受热超过80℃时,酶活力降低;当超过100℃时,叶绿素酶活力完全丧失。菠菜在生长和新鲜贮藏过程中叶绿素酶活力变化见图9-8。观察到的最大活力出现于开花起始期(虚线),与采摘时相比,采摘后新鲜菠菜在5℃贮藏时,酶活力降低(实线)。
图9-7 叶绿素及其衍生物
图9-8 在菠菜生长时(实线)和在5℃贮藏后(虚线)叶绿素酶活力,以叶绿素转化为脱植醇叶绿素的百分数表示
2.热和酸的影响
在加热或热处理过程中形成的叶绿素衍生物可根据四吡咯中心是否存在镁原子而分成两类。含镁衍生物显绿色,而无镁衍生物则显橄榄褐色,后者为螯合剂,如当存在足量的锌或铜离子时,它们可与锌或铜形成绿色络合物。
当叶绿素分子受热时,即发生异构化。由于C-10位上甲氧甲酰基被转化,从而形成了叶绿素异构体,并命名为a′和b′,与其母体化合物相比,它们在HPLC的C18反相柱上的吸附性更强,因而可得到完全分离。在经加热的植物组织或有机溶剂中,异构化反应速度加快。叶片组织在100℃时加热10min,异构化反应达到平衡,有5%~10%的叶绿素a和叶绿素b分别转化为叶绿素a′和叶绿素b′(图9-9)。
图9-9在新鲜、热烫、冷冻及罐装菠菜中叶绿素(chl)的高效液相(HPLC)色谱图
Phe=脱镁叶绿素,Pyro=焦脱镁叶绿素
叶绿素中的镁原子极易被两个氢所取代,从而形成橄榄褐色的脱镁叶绿素(图9-10),在水溶液中该反应不可逆。与其母体化合物相比,脱镁叶绿素a和脱镁叶绿素b的极性较低,在反相HPLC柱上的吸附性较强。叶绿素a比叶绿素b更容易生成脱镁叶绿素。叶绿素b比叶绿素a的热稳定性高,叶绿素b具有更高稳定性的原因是C-3位甲醛基的拉电子效应。由于叶绿素的共轭结构,使得四吡咯氮上的正电荷增加,因而导致吡啶氮氢的平衡常数降低。该反应的活化能数据范围为12.6~35.2kcal/mol。这个活化能的变化归因于介质组成、pH及温度范围。
叶绿素的降解受组织pH的影响,在碱性介质中(pH9.0),叶绿素对热非常稳定,而在酸性介质中(pH3.0),它的稳定性欠佳。植物组织在加热过程中所释放出的酸可使体系的pH降低一个单位,这对叶绿素的降解速度产生极为不利的影响。在完整无损的植物组织中或采后产品中,脱镁叶绿素的形成似乎受细胞膜破裂的调控。当甜菜叶置于缓冲液中加热时,只有升温至60℃以上时,叶绿素才开始发生降解,将其在60℃和100℃下保温60min,分别有32%和97%的叶绿素转化为脱镁叶绿素。
图9-10 由叶绿素生成的脱镁叶绿素和焦脱镁叶绿素
在加热过的烟叶中加入钠、镁和钙离子,可降低脱镁叶绿素的生成,叶绿素降解的降低应归结于盐的静电屏蔽效应。可能是所加的阳离子中和了叶绿体膜中脂肪酸和蛋白质表面的负电荷,从而降低了氢离子与膜表面的吸收力。
脱镁叶绿素C-10位上的甲氧甲酰基被氢原子取代,可形成橄榄色的焦脱镁叶绿素,焦脱镁叶绿素在红区与蓝区的最大光吸收波长均与脱镁叶绿素相同(表9-4)。
在加热过程中叶绿素的变化为序列反应,并按以下动力学过程进行:
叶绿素→脱镁叶绿素→焦脱镁叶绿素
表9-5数据显示在加热的前15min内,叶绿素快速减少而脱镁叶绿素迅速增加,再经进一步加热,脱镁叶绿素减少,而焦脱镁叶绿素快速增加。尽管在加热4min后就已有少量的焦脱镁叶绿素出现,但在前15min并未发现有明显的产物积累,因而为序列反应提供了佐证。与脱镁叶绿素a转化为焦脱镁叶绿素a相比,脱镁叶绿素b转化为焦脱镁叶绿素b的一级速度常数要高出25%~40%。从脱镁叶绿素a或b上去除C-10位上的甲氧甲酰基所需的活化能,要比叶绿素a和叶绿素b形成脱镁叶绿素a和脱镁叶绿素b所需的活化能低,这说明从脱镁叶绿素形成焦脱镁叶绿素所需要的温度略低。
表9-5 新鲜、热烫及在121℃下经不同时间热处理的菠菜中叶绿素a、叶绿素b和焦脱镁叶绿素a、焦脱镁叶绿素b的含量单位:mg/g干重
表9-6 市售罐装蔬菜中脱镁叶绿素a和叶绿素b的含量
表9-6所示为市售罐装蔬菜制品中脱镁叶绿素a和脱镁叶绿素b以及焦脱镁叶绿素a和焦脱镁叶绿素b的浓度。焦脱镁叶绿素a和焦脱镁叶绿素b是许多罐装蔬菜中叶绿素类物质的主要组分,因而可使产品显橄榄绿色。同样显而易见的是,所形成的焦脱镁叶绿素的含量也可作为热处理强度的指标。
脱植醇叶绿素(绿色)中的镁原子被氢离子取代可形成橄榄褐色的脱镁叶绿素盐,脱镁叶绿素盐a和脱镁叶绿素盐b的水溶性比相应的脱镁叶绿素大,而光谱性质则相同。C-10位上植醇链的解离似可影响四吡咯中央处镁的损失速率。在酸性丙酮中,脱植醇叶绿素a和脱植醇叶绿素b及其甲酯和乙酯的降解随链长度的缩短而增加,说明C-10位上链的空间阻碍作用可影响氢离子进攻的速率。
3.金属络合物形成
无镁叶绿素衍生物的四吡咯核中的两个氢原子易被锌或铜离子所取代,形成绿色的金属络合物。由脱镁叶绿素a和脱镁叶绿素b形成的金属络合物使得红区最大吸收峰向短波长方向移动,蓝区最大吸收峰向长波长方向移动(表9-4)。无植醇金属络合物的光谱特性与其母体化合物完全相同。
锌与铜络合物在酸性溶液中的稳定性较碱性溶液高。在室温下加酸可除去叶绿素中的镁,而锌与脱镁叶绿素a形成的络合物在pH2的溶液中仍保持稳定。只有当pH低至引起卟啉环分解时,才可除去络合物中的铜。
金属离子与中性卟啉的结合是双分子反应,该反应首先是金属离子附着于吡咯的氮原子上,随后迅速并同时脱去两个氢原子。由于四吡咯环具有高度共振结构,金属络合物的形成受取代基的影响。
叶绿素金属络合物可在植物组织内形成,并且叶绿素a络合物的形成速率高于叶绿素b络合物,b络合物形成速度较低的原因在于C-3位上甲醛基的拉电子效应。电子通过共轭卟啉环系统迁移,使得吡咯氮原子带有更多的正电荷,因而与金属阳离子的反应性较低。植醇链的空间阻碍效应也使得络合物的形成速率降低,脱镁叶绿素盐a在乙醇中与铜离子的反应速率比脱镁叶绿素a高4倍。
pH同样是影响络合物形成速率的因素之一,将菠菜泥中的pH从4.0提高至8.5,锌焦脱镁叶绿素a的含量可增加11倍。当pH提高至10时,形成的络合物数量下降,原因可能是锌形成了沉淀。
4.叶绿素的氧化作用
将叶绿素溶于乙醇或其他溶剂并暴露于空气中可发生氧化反应,这一过程称为叶绿素的氧化,在这一过程中可吸收与叶绿素等摩尔的氧。该产品呈蓝-绿色,并在Molisch相检验中表明没有形成黄-棕色的环。在试验中缺乏颜色响应说明环五酮环[环V,见图9-6(3)]已被氧化,或C-10位上的甲氧甲酰基已被消去。经氧化处理的产物已被确定为10-羟基叶绿素和10-甲氧基内酯(图9-11),叶绿素b的主要氧化产物为10-甲氧基内酯衍生物。
5.光降解作用
在由类胡萝卜素和其他脂质包围的健康植物细胞光合过程中,叶绿素受到保护使其免遭光的破坏。叶绿素对光敏感且可产生单重态氧,类胡萝卜素能够淬灭活性态氧并保护植物免于受光降解。一旦由于植物衰老、色素从组织内萃取出以后或在加工过程中细胞受到破坏,这种保护作用也就丧失,使叶绿素很容易见光分解。当以上条件占主导地位并有光和氧存在时,叶绿素可发生不可逆脱色。
图9-11 10-羟基叶绿素(1)和10-甲氧基叶绿素内酯(2)的结构
(四)热处理过程中的颜色损失
经热处理的蔬菜,由于形成了脱镁叶绿素和焦脱镁叶绿素,因而失去绿色,热烫和商业化热灭菌可使叶绿素的损失率高达80%~100%。在罐装前需对菠菜进行热烫处理,以使组织缩水便于包装,而在冷冻前需经足够的热烫处理,不仅是为了缩水,而且可使酶失活。对罐装样品色素组分的检测结果显示叶绿素已完全被转化为脱镁叶绿素和焦脱镁叶绿素。
(五)护色技术
对罐装蔬菜绿色保护所采取的措施主要集中在以下几个方面:叶绿素的保留、叶绿素绿色衍生物即叶绿素酸盐的形成和保留、或通过生成金属络合物以形成一种更易接受的绿色。
1.中和酸以保留叶绿素
在罐装绿色蔬菜中加入碱性物质可改善加工过程中叶绿素的保留率,可在热烫液中添加氧化钙和磷酸二氢钙,使产品pH保持或提高至7.0,但以上处理均导致组织软化并产生碱味。
2.高温瞬时处理
高温瞬时杀菌(HTST)比在常规温度下杀菌所需时间较短,因而与常规热处理食品相比,它们具有较好的维生素、风味和颜色保留率。经HTST处理的食品中的上述组分之所以具有较高的保留率,是因为温度对它们破坏的影响比对肉毒杆菌孢子失活的影响更大。
类胡萝卜素是自然界分布最广的天然色素,估计全球每年的生物合成量约为1亿吨,其中大部分由海藻所合成。在高等植物中,叶绿体中的类胡萝卜素常被高含量的叶绿素所掩盖。只有到秋季,植物凋谢时,其中的叶绿体开始分解,类胡萝卜素的橙黄色才显现出来。
类胡萝卜素对植物组织中的光合作用和光保护作用有着非常重要的影响,在所有含叶绿素的组织中,类胡萝卜素对收获时的光照射能起第二类色素的作用。类胡萝卜素可淬灭并失活由于遇光和空气而形成的活性氧(尤其是单重态氧),因而具有光保护作用。此外,处于根和叶部的某些类胡萝卜素是脱落酸的前体物质,后者起着化学物质信使和生长调节剂的作用。
类胡萝卜素色素在人类和其他动物的膳食中最主要的功能是可作为维生素A的前体。虽然类胡萝卜素化合物中的β-胡萝卜素具有最高的维生素A原活性,因为其拥有两个β-紫罗酮环结构(图9-12)。其他常用的类胡萝卜素如α-胡萝卜素和β-玉米黄素也具有维生素A原活性。果蔬中的维生素A原类胡萝卜素约可提供30%~100%人类所需的维生素A量。具有维生素A活性的先决条件是在胡萝卜素中是否存在视黄醇(即β-紫罗酮环)结构。所以,只有为数不多的类胡萝卜素具有维生素A活性。
图9-12 常见类胡萝卜素的结构式
来源于绿叶、玉米和万寿菊中的芦丁(黄色);来源于玉米和藏红花中的玉米黄素(黄色);来源于玉米中的β-玉米黄质(黄色);来源于胡萝卜中的β-胡萝卜素(黄色);来源于胡萝卜和甘薯中的β-胡萝卜素(黄色);来源于绿叶中的新黄素(黄色);来源于红辣椒中的辣椒红素(红色);来源于绿叶中的紫黄素(黄色)以及来源于胭脂树籽中的胭脂树素(黄色)
(一)类胡萝卜素的结构
类胡萝卜素可按其结构分成以下两类:烷烃类胡萝卜素和氧合叶黄素。氧合类胡萝卜素(叶黄素)含有很多衍生物,常见的取代基有羟基、环氧基、醛基和酮基。此外,羟基化的类胡萝卜素脂肪酸酯也广泛分布于自然界中。
类胡萝卜素的基本骨架结构为头-尾或尾-尾共价连接的异戊二烯单元,分子结构对称(图9-13),其他类胡萝卜素由此40个碳的基本结构衍化而成。某些类胡萝卜素含有两个末端环基(如图9-12中的β-胡萝卜素),而其他品种则只有一个甚至无末端环基(如图9-13中的番茄红素,番茄中的一种主要红色素)。还有一些类胡萝卜素的碳骨架较短,它们被称为胡萝卜醛(如胭脂树橙)。
植物组织中最常见的类胡萝卜素为β-胡萝卜素,无论是天然或人工合成的都可用作食用着色剂。图9-12所示为植物中的某些类胡萝卜素,它们包括α-胡萝卜素(胡萝卜)、辣椒红素(红辣椒、甜椒)、芦丁(α-胡萝卜素的二醇化合物)及其酯(万寿菊瓣)和胭脂树橙(胭脂树种子)。食物中其他常见的类胡萝卜素包括玉米黄素(β-胡萝卜素的二醇化合物)、紫黄素(类胡萝卜素的环氧化物)、新叶黄素(一种丙二烯三醇)以及β-玉米黄质(β-胡萝卜素的羟基化衍生物)。
动物中的类胡萝卜素源于所摄入的植物。例如,鲑鱼肉中的粉红素主要为虾青色,后者由含有类胡萝卜素的海生植物经消化而成。人们也已熟知某些动植物中的类胡萝卜素可与蛋白质相连接或缔合。小虾和龙虾外壳中的红色虾青素与蛋白质结合后显蓝色,加热可使复合物变性,因而改变其光谱性质及色素的视觉特性,因此颜色也由蓝变红。
(二)存在与分布
植物的可食组织中含有多种类型的类胡萝卜素,它们在红、黄及橙色水果、根类作物以及蔬菜中的含量都很丰富,最常见的为番茄(番茄红素)、胡萝卜(α-胡萝卜素和β-胡萝卜素)、红椒(辣椒红素)、南瓜(β-胡萝卜素)、西葫芦(β-胡萝卜素)、玉米(芦丁和玉米黄素)及甘薯(β-胡萝卜素)。所有绿叶蔬菜都含有类胡萝卜素,但它们被绿色叶绿素所掩盖。所有的绿色叶类蔬菜都含有类胡萝卜素,但是它们的颜色被绿色的叶绿素所掩盖。通常,最高含量的类胡萝卜素存在于那些含有大量叶绿素色素的植物组织中,例如,菠菜和花色包菜富含类胡萝卜素,而在豌豆、绿刀豆和芦笋中的含量也很显著。
图9-13 多个异戊二烯单位连接形成番茄红素(番茄中的主要红色素)
许多因素影响植物中类胡萝卜素含量。某些水果在成熟过程中可使类胡萝卜素含量发生显著变化。例如在番茄中,类胡萝卜素尤其是番茄红素,在成熟过程中含量显著增加,因而,它们的含量随植物的成熟期而发生变化。甚至在收获后,番茄中的类胡萝卜素合成反应继续进行。由于光可增强类胡萝卜素的生物合成,因而光照强度可影响其含量。影响类胡萝卜素存在和含量的其他因素包括生长气候、杀虫剂和肥料的使用以及土壤类型等。
(三)物理性质、萃取和分析
各种类胡萝卜素均为亲脂化合物,因而它们可溶于油和有机溶剂中。类胡萝卜素具有中度热稳定性,但受氧化后易褪色。类胡萝卜素因热、酸和光的作用而易发生异构化。由于它们的显色范围为黄至红色,因而分析类胡萝卜素的检测波长为430~480nm。为了防止叶绿素的干扰,常采用较高的波长测定某些叶黄素。许多类胡萝卜素与各类试剂反应后,光谱发生偏移,这些变化有助于结构鉴定。
植物食品中类胡萝卜素的复杂性和多样性使得人们必须采用色谱分离方法。常用的萃取方法是从组织中定量收集类胡萝卜素,所用的有机溶剂必须能渗透至亲水基质中。为达到此目的,常采用己烷-丙酮混合溶剂,但有时为了取得满意的分离效果,需采用特殊的溶剂和处理方法。
包括高效液相色谱在内的许多色谱分离手段已用于分离类胡萝卜素。当需要分离类胡萝卜素酯、顺反异构体和光学异构体时,必须采用特殊的分析手段。
(四)化学性质
1.氧化
类胡萝卜素具有许多共轭双键,故极易被氧化。此反应可导致食品中类胡萝卜素的褪色,并是主要的降解机制。特定色素对氧化的稳定性在很大程度上取决于它所处的环境。在组织中,色素通常受到隔离因而免受氧化。但是,当组织遭受到物理损伤或在提取类胡萝卜素时,类胡萝卜素对氧化的敏感性增加。此外,贮藏于有机溶剂中的类胡萝卜素色素通常会加速分解。由于类胡萝卜素具有高度共轭的不饱和结构,因而它们的降解产物非常复杂。
图9-14所示为β-胡萝卜素在氧化和热处理过程中的各类降解产物。在氧化过程中,首先形成环氧化物和羰基化合物,继续氧化可形成短链单环或双环氧合物,如环氧-β-紫罗兰酮。通常环氧结构主要处于末端环上,但氧化反应可切入链上其他许多部位。对于维生素A原类胡萝卜素,在环上形成环氧化物可导致维生素A原活性损失。剧烈的自动氧化反应可使类胡萝卜素色素漂白并使其褪色。若有亚硫酸盐和金属离子存在时,β-胡萝卜素的氧化降解加剧。
图9-14 全反式β-胡萝卜素的降解
酶尤其是脂肪氧合酶可加速类胡萝卜素色素的氧化降解。这一反应为间接机制。脂肪氧合酶首先催化不饱和或多不饱和脂肪酸的氧化,形成过氧化物,后者再与类胡萝卜素色素反应。因而常可根据溶液中的褪色程度和吸光度的下降,测定脂肪氧合酶的活力。
2.抗氧化活性
由于类胡萝卜素易被氧化,无疑它应具有抗氧化剂的特性。类胡萝卜素除了可在细胞内或活体外对单重态氧引起的反应起保护作用外,在低氧分压时,还可抑制脂肪的过氧化反应。在高氧分压条件下,β-胡萝卜素具有促氧化反应特性。当有分子氧、光敏化剂(即叶绿素)和光存在时,可产生单重态氧,具有高度的氧反应活性。现已知类胡萝卜素可淬灭单重态氧,因而可保护细胞免遭氧化破坏。并非所有的类胡萝卜素都可起到相同的光化学保护剂作用。例如,与其他类胡萝卜素色素相比,番茄红素对淬灭单重态氧特别有效。
3.顺/反异构化
通常类胡萝卜素的共轭双键多为全反构型,只发现为数不多的顺式异构体天然存在于一些植物组织尤其是藻类中,藻类采收后可作为类胡萝卜素色素的来源。热处理、有机溶剂、与某些活性表面长期接触、遇酸及溶液经光照(尤其是有碘存在时)极易引起异构化反应。由于类胡萝卜素中存在着众多的双键,因而在理论上异构化反应可能产生大量的几何异构体,例如,β-胡萝卜素具有272种可能存在的异构体。然而由于空间抑制作用,胡萝卜素中仅有少量的顺式异构体存在。顺/反异构体同样影响类胡萝卜素的维生素A原活性,但不会影响其颜色。β-胡萝卜素的顺式异构体的维生素A原活性依其异构化的构型,约为全反式β-胡萝卜素的13%~50%。
4.加工中的稳定性
在大多数果蔬的典型贮藏和加工中,类胡萝卜素的性质相对稳定,冷冻对类胡萝卜素含量的影响极微。但是热烫可引起类胡萝卜素含量的变化,常需热烫的植物制品中类胡萝卜素含量比原料组织有明显增加,这是因为脂肪氧合酶可催化类胡萝卜素的氧化分解,并使可溶性组分进入热烫液而造成损失,而热烫可使该酶失活。常规热烫所采用的温和热处理也可使色素的提取效率比从新鲜组织中直接提取更高。此外,几种物理法的捣碎及热处理也可增加提取率及使用时的生物利用率。通常用于甘薯的碱液脱皮仅造成极微类胡萝卜素的破坏或异构化。
曾经认为类胡萝卜素遇热相对稳定,但现证明加热灭菌可引起顺/反异构化反应(图9-14)。为了避免过度异构化,热处理强度应尽可能降低。以挤压蒸煮和油浴高温加热为例,加工过程不仅可引起类胡萝卜素的异构化反应,亦可造成热降解。类胡萝卜素在高温下,可形成挥发性裂解产物,β-胡萝卜素在有空气时剧烈加热所得到的产物与β-胡萝卜素加热氧化时的产物类似(图9-14)。与此相反,气流脱水使得类胡萝卜素更易与氧接触,因而可引起类胡萝卜素的大量降解。脱水产品如胡萝卜和甘薯片具有较高的比表面积,在干燥或空气中贮藏时极易氧化分解。
当形成顺式异构体时,只有很小的光谱偏移,因而产品的色泽基本不受影响;然而,维生素A原活性却有所下降。
(一)花色苷
酚类物质由一大类有机物质组成,类黄酮是其重要一族。类黄酮族物质中含有花色苷,它是一种植物界中分布最广的色素。在植物中,花色苷具有各种颜色,如蓝、紫、紫罗兰色、深红、红及橙色等。花色苷一词取自两个希腊语Anthos(花)和Kyanos(蓝色)。这类物质多年来引起了化学家的关注,两位研究者Robert Robinson爵士和Richard Willstätter教授因其对植物色素所作的贡献而获得诺贝尔化学奖。
1.结构
花色苷具有典型的C6C3C6碳骨架结构,因而是一种类黄酮。类黄酮物质的基本化学结构以及与花色苷的关系见图9-15。每组中都有很多种不同的化合物,各种化合物的颜色依分子上取代基的存在及其数量而异。
花色苷的基本结构为黄 盐的2-苯基-苯-吡喃
盐的2-苯基-苯-吡喃 结构(图9-16)。花色苷以该盐的多羟基及/或多甲氧基衍生物的糖苷式存在。不同花色苷的区别在于以下几个方面:所存在的羟基及/或甲氧基的数量;与分子相连接的糖基的类型、数量及位置;以及连接在分子中糖基上的脂肪酸或芳香族羧酸的类型及数量。
结构(图9-16)。花色苷以该盐的多羟基及/或多甲氧基衍生物的糖苷式存在。不同花色苷的区别在于以下几个方面:所存在的羟基及/或甲氧基的数量;与分子相连接的糖基的类型、数量及位置;以及连接在分子中糖基上的脂肪酸或芳香族羧酸的类型及数量。
图9-15 一些重要类黄酮的碳骨架,根据其C-3链结构的分类
图9-16 黄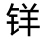 盐阳离子
盐阳离子
R1及R2=-H,-OH或-OCH3,R3=糖基,R4=-H或糖基(https://www.xing528.com)
最常见的糖基为葡萄糖、鼠李糖、半乳糖、阿拉伯糖、木糖和由这些单糖形成的同质或异质二糖及三糖。参与糖基酰化最常见的酸为芳香族羧酸,包括p-香豆酸、咖啡酸、阿魏酸、芥子酸、没食子酸、或p-羟基苯甲酸,以及脂族酸如丙二酸、乙酸、苹果酸、琥珀酸和草酸。这些酰基取代基通常连接于C-3位的糖上,与6-OH酯化,有时也可与糖的4-OH酯化。
当花色苷上的糖基部分被水解后,糖苷配基(水解产物的非糖部分)被称为花色素。花色苷和花色素分子受到可见光激发,从而形成各种颜色。分子受激发的难易程度取决于结构中的电子相对流动性。花色苷和花色素中富含的双键极易受到激发,因而它们对成色至关重要。天然存在19种花色素,而通常仅有6种存在于食品中(图9-17)。
图9-17 食品中最常见的花色苷,按红色色度和蓝色色度增加方向排列
随着花色素分子上取代基的增加,色调逐渐加深,这是由于发色团的红移(向长波长处移动),即可见光谱中光吸收波段从短波长向长波长方向移动,结果颜色由橙/红变成紫/蓝。与此相反的变化称为蓝移。红移效应由助色团形成,助色团本身并不发色,但当它们与分子结合后,可使色调加深。助色团是电子供体,在花色素中,通常为羟基和甲氧基。由于甲氧基的供电子能力高于羟基,因而其红移能力亦高。图9-17所示为甲氧基数目对红色的影响。
花色素的水溶性比相应的糖苷(花色苷)低,因而在自然界中并无游离花色素存在。
2.花色苷的颜色和稳定性
花色苷色素的稳定性相对较低,在酸性条件下稳定性最高。该色素的颜色特性(色调和色度)和稳定性均受糖苷配基上取代基的强烈影响。花色苷的降解不仅发生在从植物组织提取过程中,而且存在于食物组织的加工和贮藏过程中。
影响花色苷降解的主要因素为pH、温度和氧浓度,一些次要因素通常为降解酶、抗坏血酸、二氧化硫、金属离子和糖。此外,共色素形成作用也会或可能会影响花色苷的降解速率。
3.结构变化与pH的影响
由于花色苷的结构多样性,其降解速率变化很大。通常羟基化程度提高会使其稳定性下降,而甲基化程度提高则可使其稳定性增加。富含天竺葵色素、矢车菊色素或飞燕草色素类糖苷配基等花色苷的食物颜色,比富含牵牛花色素和锦葵色素类糖苷配基者更不稳定,这是因为后者具有反应活性的羟基被封闭,因而稳定性增加。
在水溶液及食品中,依pH不同,花色苷存在4种可能的结构形式[图9-18(1)]:蓝色醌型碱(A)、红色黄 盐阳离子(AH+)、无色醇型假碱(B)和无色查耳酮(C)。图9-18为锦葵色素-3-葡萄糖苷[图9-18(2)]、二羟基黄
盐阳离子(AH+)、无色醇型假碱(B)和无色查耳酮(C)。图9-18为锦葵色素-3-葡萄糖苷[图9-18(2)]、二羟基黄 盐氯化物[图9-18(3)]和4-甲氧基-4-甲基-7-羟基黄
盐氯化物[图9-18(3)]和4-甲氧基-4-甲基-7-羟基黄 盐氯化物[图9-18(4)]在pH0~6时4种结构式的平衡分布曲线。对于每种色素而言,在整个pH范围内四种结构中只有两种占主导地位。
盐氯化物[图9-18(4)]在pH0~6时4种结构式的平衡分布曲线。对于每种色素而言,在整个pH范围内四种结构中只有两种占主导地位。
锦葵色素-3-葡萄糖苷的水溶液在低pH时黄 盐结构占优势,而在pH4~6时,无色的醇型假碱结构占优势。4′,7-羟基黄
盐结构占优势,而在pH4~6时,无色的醇型假碱结构占优势。4′,7-羟基黄 盐也存在类似现象,只是其平衡产物主要含有黄
盐也存在类似现象,只是其平衡产物主要含有黄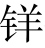 盐和查耳酮结构。所以,当pH接近6时,溶液变为无色。在4′-甲氧基-4-甲基-7-羟基黄
盐和查耳酮结构。所以,当pH接近6时,溶液变为无色。在4′-甲氧基-4-甲基-7-羟基黄 盐氯化物的水溶液中,黄
盐氯化物的水溶液中,黄 盐阳离子和醌型碱之间存在着平衡,因而溶液在pH0~6显色,随着pH在此范围内提高,溶液从红色变为蓝色。
盐阳离子和醌型碱之间存在着平衡,因而溶液在pH0~6显色,随着pH在此范围内提高,溶液从红色变为蓝色。
图9-18(1)室温下存在于酸性水溶液中的四种花色苷结构式;A,醌型碱(蓝色);(AH+),黄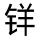 盐(红色);B,假碱或醇式(无色);C,查耳酮(无色)。(2)~(4)25℃下AH+、A、B及C随pH变化的平衡分布;(2)3-葡萄糖基锦葵色素;(3)4′,7-羟基黄
盐(红色);B,假碱或醇式(无色);C,查耳酮(无色)。(2)~(4)25℃下AH+、A、B及C随pH变化的平衡分布;(2)3-葡萄糖基锦葵色素;(3)4′,7-羟基黄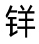 盐氯化物;(4)4′-甲氧基-4-甲基-7-羟基黄
盐氯化物;(4)4′-甲氧基-4-甲基-7-羟基黄 盐氯化物
盐氯化物
图9-19为矢车菊色素-3-鼠李糖葡萄糖苷在pH0.71~4.02的缓冲液中的光谱,虽然在整个pH范围内最大吸收峰保持不变,但吸光强度随pH增加而降低。蔓越菊花色苷色素混合物的颜色随pH的变化见图9-20。蔓越菊花色苷色素在水溶液中的变化情况与在鸡尾酒中相同,pH是影响色泽变化的主要因素。花色苷的着色强度在pH约为1.0时最大,此时色素分子大多以离子化形式存在。在pH4.5时,若无黄色类黄酮存在,果汁中的花色苷接近无色(略带蓝色);若有黄色色素存在(在水果中很常见),果汁将会变绿。
图9-19 3-鼠李葡萄糖-矢车菊色素在pH0.71~4.02缓冲液中的吸收光谱(色素浓度为1.6 × 10-2g/L)
图9-20 蔓越菊花色苷的吸光度与pH的关系
4.温度
食品中花色苷的稳定性受温度的强烈影响,其降解速率也受氧的存在与否的影响。高度羟基化的花色苷色素与甲基化、糖基化和酰基化异构体相比,稳定性较低。
加热可使平衡向查耳酮方向移动,而逆反应速度则比正反应速度低。例如,以3,5-二糖苷查耳酮为起始物的反应需12h才能达到平衡。由于通常采用分析黄 盐含量的方法来测定残留色素含量,若反应时间不足于达到平衡时,有可能产生误差。
盐含量的方法来测定残留色素含量,若反应时间不足于达到平衡时,有可能产生误差。
花色苷热降解的确切机理尚未完全了解,现已提出了3种途径。香豆素-3,5-二糖苷是花色素(矢车菊、甲基花色素、飞燕草色素、牵牛花色素和锦葵色素)3,5-二糖苷的常见降解产物(图9-21)。按途径(1),黄 盐阳离子首先转变为醌式碱,然后生成几种中间体,最后形成香豆素衍生物和B环化合物。按途径(2)(图9-21),黄
盐阳离子首先转变为醌式碱,然后生成几种中间体,最后形成香豆素衍生物和B环化合物。按途径(2)(图9-21),黄 盐阳离子首先转变成无色醇式碱,然后变为查耳酮,最后生成棕色降解产物。途径(3)(图9-21)与此类似,只是首先形成的降解产物为查耳酮。上述三种已提出的反应途径说明花色苷的热降解取决于所涉及的花色苷种类和降解温度。
盐阳离子首先转变成无色醇式碱,然后变为查耳酮,最后生成棕色降解产物。途径(3)(图9-21)与此类似,只是首先形成的降解产物为查耳酮。上述三种已提出的反应途径说明花色苷的热降解取决于所涉及的花色苷种类和降解温度。
图9-21 3,5-二糖苷花色素与3-二葡萄糖苷花色素的降解机制
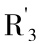 ,
,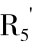 =—OH,—H,—OCH3或—OGL;GL=葡萄糖基
=—OH,—H,—OCH3或—OGL;GL=葡萄糖基
5.氧和抗坏血酸
花色苷结构的不饱和性使其对分子氧很敏感,通过充氮灌装或真空处理含花色苷色素果汁可除去氧,对保留花色苷颜色的有利。无糖饮料葡萄汁在氮气氛中灌装时,其色素稳定性可得到大幅度提高。
在果汁中抗坏血酸与花色苷同时消失,这说明在两种分子间存在着某种直接的相互作用。抗坏血酸诱发的花色苷降解,是由于抗坏血酸在氧化过程中形成的过氧化氢的间接作用所致。当有铜离子存在时可加速反应,而当有黄酮醇如栎精和栎素存在时则受到抑制。促使抗坏血酸氧化的条件不利于形成H2O2,这就解释了在某些果汁中花色苷的稳定性。H2O2通过对花色苷C-2位亲核进攻使吡喃环裂解,从而生成无色的酯和香豆素衍生物。这类降解产物可进一步分解或聚合,最终导致果汁中常见的棕色沉淀现象。
6.光
光可加速花色苷的降解,在几种果汁和红酒中都可观察到此类不利影响。果酒中酰基化和甲基化的二糖苷较非酰基化的二糖苷稳定,而后者的稳定性较单糖苷高。共色素形成作用(花色苷自缩合或与其他有机物的缩合反应)视不同情况可加速或延缓降解反应。多羟基黄酮、异黄酮和磺酸噢哢对光降解起保护作用,该保护作用是由于带负电荷的磺酸盐与带正电荷的黄 盐相互作用,在分子间形成环(图9-22)。花色苷C-5位羟基团被取代后,其光降解敏感性较未取代时高,而未取代或单取代花色苷在C-2及/或C-4位更易受到亲核进攻。其他形式的辐射如离子化辐射的能量也可造成花色苷的降解。
盐相互作用,在分子间形成环(图9-22)。花色苷C-5位羟基团被取代后,其光降解敏感性较未取代时高,而未取代或单取代花色苷在C-2及/或C-4位更易受到亲核进攻。其他形式的辐射如离子化辐射的能量也可造成花色苷的降解。
图9-22 由花色苷与多羟基黄酮磺酸盐形成的分子络合物
7.糖及其降解产物
果汁所含的高浓度糖分可稳定花色苷,这一作用是由于降低了水分活度(表9-7)。水亲核进攻黄 盐阳离子的C-2位,形成无色醇式碱。当所存在的糖分低至对水分活度影响很少时,它们或其降解产物有时可加速花色苷的降解。在低浓度时,果糖、阿拉伯糖、乳糖和山梨糖对花色苷的降解作用比葡萄糖、蔗糖和麦芽糖大。花色苷的降解速率与糖降解为糠醛的速率一致。由戊醛糖所形成的糠醛,或由己酮糖形成的羟甲基糠醛,均为美拉德反应和抗坏血酸氧化的产物。此类化合物易与花色苷发生缩合反应,形成棕色物质。
盐阳离子的C-2位,形成无色醇式碱。当所存在的糖分低至对水分活度影响很少时,它们或其降解产物有时可加速花色苷的降解。在低浓度时,果糖、阿拉伯糖、乳糖和山梨糖对花色苷的降解作用比葡萄糖、蔗糖和麦芽糖大。花色苷的降解速率与糖降解为糠醛的速率一致。由戊醛糖所形成的糠醛,或由己酮糖形成的羟甲基糠醛,均为美拉德反应和抗坏血酸氧化的产物。此类化合物易与花色苷发生缩合反应,形成棕色物质。
表9-7在加热过程中由吸光值测定得到的水分活度对花色苷颜色稳定性的影响
续表
8.金属
在植物界中,花色苷的金属络合物很常见,它们拓展了花的色谱。金属罐内壁必须涂膜,以便金属罐内果蔬在杀菌过程中保留果蔬中花色苷的典型颜色。花色苷含有相邻的酚羟基,可螯合几种多价金属,螯合物会产生红移,使其颜色向蓝波方向移动。在花色苷溶液中添加AlCl3,将花青素、配基和飞燕草色素与天竺葵色素、芍药色素和锦葵色素区分开来。后一类花色苷不具有邻酚羟基,因而不能与Al3+反应(图9-17)。金属络合作用可稳定含花色苷食品的颜色,Ca、Fe、Al和Sn离子对蔓越菊汁中的花色苷提供一些保护作用。然而,金属与单宁形成的络合物可使蓝色和棕色变色,因而抵消了其有利影响。
水果的变色问题,即所谓“红变”,是由于金属与花色苷形成了络合物所致。已发现这类变色现象出现于梨、桃和荔枝中。红变是由于无色的原花色素在酸性条件下受热转化为花色苷,然后再与金属形成络合物之故。
9.二氧化硫
在黑樱桃酒、蜜制和糖渍樱桃生产过程中的一个加工步骤是用高浓度的SO2(0.8%~1.5%)将花色苷漂白。将含有花色苷的水果保存于500~2000mg/L的SO2中,可生成无色的络合物,该反应涉及到SO2在C-4位的结合(图9-23)。SO2在C-4位结合的原因是SO2在这一位置打断了共轭双键体系,从而导致颜色的损失。天竺葵3-葡萄糖苷的失色反应速率常数(k)为25700μA,具有较大的速率常数表明只需少量的SO2即可快速地使大量的花色苷变色。某些花色苷可抵御SO2漂白,可能是C-4位已封闭或通过4位连接以二聚体形式存在。发生于黑樱桃酒和樱桃蜜饯生产过程中的漂白为不可逆过程。
图9-23 无色花色苷-硫酸盐(-SO2)络合物
10.共色素形成作用
已知花色苷可与自身(自身结合)或其他有机物(共色素形成作用)发生缩合反应,并可与蛋白质、单宁、其他类黄酮和多糖形成较弱的络合物。虽然这些化合物大部分本身并不显色,但它们可通过红移作用增强花色苷的颜色,并增加最大吸收峰波长处的吸光强度,这些络合物在加工和贮藏过程中也更稳定。
在葡萄酒加工过程中,花色苷经历了一系列的反应后,形成了更加稳定复杂的葡萄酒色素。葡萄酒中稳定的颜色是由于花色苷的自身结合所致。该聚合物对pH较不敏感,并由于在4位上有接合基团,它们可抵御SO2的脱色作用。此外,在葡萄酒中也发现有花色苷的衍生色素(Vitisin A和Vitisin B)存在,它们分别是锦葵色素与丙酮酸或乙醛的反应产物。这一反应导致在可见波长范围内吸收的蓝移,产生比锦葵色素典型的蓝紫色更显橘黄或红的色调。然而,Vitisin对整个葡萄酒的颜色贡献相对较小。
当黄 盐阳离子及/或醌式碱吸附在合适的底物如果胶或淀粉上时,可使花色苷保持稳定。此稳定作用可增加其作为潜在食用色素添加剂的适用性,而其他缩合反应则可导致褪色。某些亲核物质如氨基酸、间苯三酚和儿茶酚可与黄
盐阳离子及/或醌式碱吸附在合适的底物如果胶或淀粉上时,可使花色苷保持稳定。此稳定作用可增加其作为潜在食用色素添加剂的适用性,而其他缩合反应则可导致褪色。某些亲核物质如氨基酸、间苯三酚和儿茶酚可与黄 盐阳离子缩合,生成无色的4-取代黄
盐阳离子缩合,生成无色的4-取代黄 盐-2-烯,结构如图9-24所示。
盐-2-烯,结构如图9-24所示。
图9-24 由黄图9-25 特定类黄酮的吸收光谱图9-21 3,5-二糖苷花色素与3-二葡萄糖苷花色素的降解机制 盐与(1)乙基甘氨酸,(2)间苯三酚,(3)儿茶酸及(4)抗坏血酸缩合得到的无色4-取代黄酮二烯
盐与(1)乙基甘氨酸,(2)间苯三酚,(3)儿茶酸及(4)抗坏血酸缩合得到的无色4-取代黄酮二烯
(二)其他类黄酮
花色苷是存在最广的一种类黄酮。虽然在食品中大多数黄色是由类胡萝卜素所致,但某些黄色是由于非花色苷型类黄酮的存在所造成。此外,类黄酮的存在也会使一些植物原料显白色,但那些含有酚类基团的氧化产物在自然界中显棕色和黑色。Anthoxanthin(黄酮,希腊语:anthos,花;xanthos,黄色)一词有时也用来命名一些黄酮类物质。与Flavonoids(类黄酮)不同的是C-3位连接的氧化状态(图9-25)。
通常在自然界中发现的结构在黄酮-3-醇(儿茶酸)至黄酮醇(3-羟基黄酮)和花色苷之间变化。类黄酮同样也包括二氢黄酮、二氢黄酮醇或二羟基二氢黄酮醇和黄酮-3,4-二醇(原花色素)。此外,有五类化合物不具备类黄酮基本骨架,但它们与类黄酮有相关的化学性质,因而通常也将其归入类黄酮族。它们是二羟基查耳酮、查耳酮、异黄酮、新黄酮和噢哢。
1.物理性质
类黄酮的光吸收特性清楚地表明,其色泽与分子中不饱和度和助色团(存在于分子中可加深颜色的基团)的影响之间存在着某种联系。在羟基取代的黄酮类物质儿茶酸和花色苷前体中,两个苯环之间的不饱和双键被打断,因而其光吸收性质与酚类似,其最大吸收在275~280nm[图9-25(1)]。在二氢黄酮类物质柚柑黄素中,羟基仅与C-4位的羰基耦合,因而并不具有助色性[图9-25(2)],所以其光吸收性质与黄酮类似。而在黄酮类物质芦丁[图9-25(3)]中,其羟基通过C-4位共轭从而使两个苯环之间发生联系,因而具有助色性。长波长(350nm)的光吸收与B环有关,而短波长的光吸收则受A环影响。与黄酮相比,在黄酮醇类物质栎精中,C-3位的羟基可使最大吸收峰继续向长波(380nm)方向移动[图9-25(3)],所以如果存在足量的黄酮醇,其色泽应显黄色。酰化及/或糖基化可使光吸收性质进一步发生改变。
图9-24由黄图9-25 特定类黄酮的吸收光谱
此类类黄酮也可涉及共色素形成作用,这一现象对自然界中的许多颜色产生重要影响。此外,与花色苷类似,类黄酮也是一种金属螯合剂,与铁和铝螯合后可增加黄色度,而当芦丁与铝螯合后则显亮黄色(390nm)。
2.在食品中的重要性
非花色苷类(NA)类黄酮对食品的颜色具有一定贡献,但是,大多数NA类黄酮通常色调苍白,因而限制了其应用。某些蔬菜如花菜、球葱和马铃薯的白色在很大程度上应归结于NA类黄酮,但它们通过共色素形成作用对颜色的贡献更为重要。该类化合物的螯合性质可对食品的色泽可产生积极或消极的影响。例如,芦丁(3-芦丁苷栎精)与三价铁络合后,可使罐装芦笋变为暗绿色,加入螯合剂如乙二胺四乙酸(EDTA)可抑制这种不利的颜色。芦丁与锡形成的络合物具有非常漂亮的黄色,在用普通锡罐罐装蜡质青豆这种加工方法未被取消前,蜡质青豆可接受的黄色在很大程度上应归结于这类络合物。锡-芦丁络合物比铁络合物性质稳定,因而只需加入或存在极少量的锡即有利于形成锡络合物。
熟黑橄榄的颜色部分是由于类黄酮的氧化产物所致,所涉及的一种类黄酮为毛地黄-7-葡萄糖苷。该化合物可经氧化并形成黑色,它存在于发酵过程及随后的贮藏过程中。食品中类黄酮的其他重要功能是其抗氧化性和对风味的贡献,尤其是苦味。
3.原花色素
虽然这类化合物并不显色,但它们与花色素具有结构类似性,在食品加工过程中,它们可转化为有色产物。原花色素又称为无色花色素或无色花色苷,用于描述此类无色化合物的其他术语有花黄素、白花色素等。无色花色素也可以二聚体、三聚体或多聚体形式存在,单体间通常通过C-4和C-8或C-4和C-6连接。
图9-26 原花色素的基本结构
原花色素在可可豆中首次发现,在酸性条件下受热后水解为矢车菊色素和(-)-表儿茶素(图9-27)。二聚原花色素存在于苹果、梨、可乐果及其他水果中。这类化合物在空气中或见光可降解为稳定的红棕色衍生物,它们对苹果汁及其他果汁的色泽和某些食品的收敛性有显著作用。为了产生收敛性,可将2~8个原花色素与蛋白质相互作用。其他在自然界中发现的原花色素在水解时可形成常见的花色素,如天竺葵色素、牵牛花色素或飞燕草色素。
图9-27 原花色素的酸水解机制
4.单宁
目前单宁还没有严格的定义,许多结构各异的物质都包含在这一名称下。单宁是一类特殊的酚类化合物,之所以取此名完全是由于它具有结合蛋白质和其他聚合物如多糖的能力,而与其本身的化学性质无关。因而,该类物质可依其功能性定义为具有沉淀生物碱、明胶和其他蛋白质能力,且相对分子质量在500~3000的水溶性多酚化合物。它们存在于橡树皮和水果中,其化学性质相当复杂。一般认为它们分属于两类:①原花色素,也称为“缩合单宁”;②属于六羟基二酚酸一类的没食子酸葡萄糖聚酯(图9-28)。后一类物质由葡萄糖苷分子与不同的酚基团键合而成,它们也被称作可水解单宁。单宁具有沉淀蛋白质的能力,因而可作为一种有价值的澄清剂。
5.醌类和氧杂蒽酮类
醌类化合物属酚类物质,其分子质量大小不一,有1,4-苯醌,二聚体1,4-萘醌,三聚体9,10-蒽醌类单体以及以金丝桃蒽醌为代表的多聚体(图9-29)。它们广泛分布于植物尤其是树中,并在树木中起呈色作用。大多数醌类物质具有苦味,对植物的呈色作用很小。它们也具有某些较深的颜色,如某些真菌和地衣的黄、橙及棕色,以及海百合和介壳虫的红、蓝和紫色。具有复杂取代基如萘醌和蒽醌的化合物存在于植物中,它们具有深紫和黑色。氧杂蒽酮类色素属于黄色酚类色素,由于它们的结构特征,常与醌类物质和类黄酮相混淆。在芒果中,氧杂蒽酮类色素芒果素(图9-30)以葡萄糖苷形式存在。根据其光谱特性,很容易与醌类物质区别开来。
图9-28 单宁的结构式
图9-29 醌类化合物的结构式
图9-30 芒果苷的结构式
(一)结构
含有甜菜色素的植物的颜色与含有花色苷的植物的颜色类似。甜菜色素是一类含有β-矢车菊色素(红色)和β-叶黄素(黄素)的色素,它与花色苷的性质不同,不受pH的影响。甜菜色素具有水溶性,并以内盐(两性离子)的形式存在于植物细胞的液泡中。含有该类色素的植物只限在中央种子目(Centrospermae)的10个科中,并在植物中与花色苷相互排斥。甜菜色素的通式[图9-31(1)]说明该物质由伯胺或仲胺与甜菜醛氨酸(BA)缩合而成[图9-31(2)]。所有甜菜色素均能以1,2,4,7,7-五取代-1,7-重氮庚胺表示[图9-31(3)]。当R′与1,7-重氮庚胺体系不相共轭时,该化合物的最大吸收峰约在480nm处,并具有β-叶黄素的典型黄色。若共轭体系延伸至R′,最大吸收峰则移至约540nm处,此时具有β-矢车菊色素的典型红色。
图9-31 甜菜色素的通式
由于β-矢车菊色素具有C-2和C-15两个手性碳原子(图9-32),因而它具有光学活性。β-矢车菊色素水解后可生成甜菜苷配基(图9-32)或C-15差向异构的异甜菜苷配基[图9-32(4)],或者是两个糖苷配基异构体的混合物。所有的β-矢车菊色素均可共享这两个糖苷配基,并已发现在糖苷部分不同的β-矢车菊色素存在着差异。含有甜菜色素的常见蔬菜为红甜菜和苋菜,后者在新鲜上市时像“绿叶”或在成熟时像红色染料。研究最广泛的甜菜色素来自红甜菜中,红甜菜中主要的β-矢车菊色素为甜菜苷或异甜菜苷[图9-32(2)(5)],而在苋菜红中,则为苋菜红素及异苋菜红素[图9-32(3)(6)]。
首例经分离鉴定的β-叶黄素为梨果仙人掌黄素[图9-33(1)]。在结构上,这类色素与β-矢车菊色素很相似,β-叶黄素与β-矢车菊色素的不同之处在于后者的吲哚核被一氨基酸取代。在梨果仙人掌黄素中,取代的氨基酸为脯氨酸。自甜菜中分离得到的两种β-叶黄素为仙人掌黄质Ⅰ和Ⅱ[图9-33(2)],它们不同于梨果仙人掌黄素,后者被脯氨酸取代,而前者则分别由谷氨酰胺或谷氨酸取代。虽然至今只有为数不多的β-叶黄素已被鉴定,但考虑到色素中氨基酸的数量,有可能存在大量不同的β-叶黄素。
甜菜色素可强烈吸收光,甜菜苷的摩尔吸光系数值为1120,而仙人掌黄质则为750,由此可说明在纯物质时它们具有很高的着色力。在pH4.0~7.0范围内,甜菜苷溶液的光谱性质未有变化,其最大吸收峰在537~538nm处,在此pH范围内,色度也不会变化。在pH低于4.0时,最大吸收峰向短波方向移动(pH2.0时为535nm);而当pH高于7.0时,最大吸收峰向长波方向移动(pH9.0时为544nm)。
图9-32 β-矢车菊色素的结构式
图9-33β-叶黄素的结构式
(二)化学性质
像其他天然色素一样,甜菜色素受几种环境因素的影响。
1.热与酸度
在温和的碱性条件下,甜菜苷可降解为甜菜醛氨酸(BA)及环多巴-5-O-葡萄糖苷(CDG)(图9-34)。当加热甜菜苷的酸性溶液或热处理含有甜菜根的产品时,也可形成以上两种降解产物,但速度较慢。该反应与pH有关(表9-8),在pH4.0~5.0范围内稳定性最高。应当注意的是该反应需要有水参与,因而当无水或水分有限时,甜菜苷相当稳定。由此可见,降低水分活度可减缓甜菜苷的降解速率。最适合贮藏甜菜粉的色素的推荐水分活度为0.12(水分含量约为2%,干基)。
甜菜苷降解成BA和CDG为可逆反应,因而在受热后部分色素可再生。所提出的再生机制涉及BA的醛基与CDG的亲核氨基之间的席夫-碱缩合反应(图9-34)。甜菜苷的再生在中间pH范围内(4.0~5.0)最高。
图9-34 甜菜苷的降解反应
由于β-矢车菊色素在C-15位存在手性碳(图9-32),因而使其具有两个差向异构体。酸或热均可导致差向异构化反应,因而在含甜菜苷食品的加热过程中,异甜菜苷对甜菜苷的比例会提高。脱羧速率随酸度提高而增加,在酸及/或受热条件下甜菜苷的降解反应总结见图9-35。
图9-35在遇酸及/或受热条件下甜菜苷的降解
2.氧和光照
造成甜菜色素降解的另一个主要因素是氧的存在,当溶液中存在的氧超过甜菜苷1mol以上时,甜菜苷的损失遵循一级动力学反应,当分子氧浓度降至接近甜菜苷时,其降解偏离一级动力学反应。而无氧存在时,其稳定性增加。分子氧已被视作甜菜苷氧化降解的活化剂。因为甜菜色素对氧化很敏感,这些化合物也是有效的抗氧化剂。在有氧条件下甜菜苷的降解也受pH的影响(表9-8)。
表9-8 在90℃下氧和pH对甜菜苷水溶液半衰期的影响
光可加速甜菜色素的氧化反应,当有抗氧化剂如抗坏血酸或异抗坏血酸存在时,可改善其稳定性。由于铜离子和铁离子可催化分子氧氧化抗坏血酸,它们可降低抗坏血酸作为甜菜色素保护剂的功效。金属螯合剂(EDTA或柠檬酸)的存在可大大改善抗坏血酸作为甜菜色素稳定剂的功效。
图9-36 甜菜苷遇过量脯氨酸时梨果仙人掌黄素的形成
图9-37 在pH5.0、90℃及大气条件下,存在于脯氨酸溶液中的甜菜苷仙人掌黄质I与梨果仙人掌黄素稳定性比较
几种酚类抗氧化剂如叔丁基羟基茴香醚、叔丁基羟基甲苯、儿茶酚、栎精、正二氢愈疮酸、绿原酸及α-生育酚,可抑制自由基链自动氧化反应。由于甜菜色素的氧化反应似乎并不涉及自由基氧化过程,因而此类抗氧化剂对甜菜苷是一种无效的稳定剂就不足为奇了。同样,含硫抗氧化剂如亚硫酸钠和偏亚硫酸氢钠不仅是无效稳定剂,而且可加剧色素损失。硫代硫酸钠是一种低劣的氧清除剂,它对甜菜苷的稳定性毫无作用。硫代丙酸和半胱氨酸也是甜菜苷的无效稳定剂。以上发现证实甜菜苷的降解不遵循自由基机制。甜菜色素对氧的敏感性限制了它作为食品色素的应用。
红曲米即红曲,古称丹曲,是我国的传统产品。红曲米是由曲霉科(Zuroticaceae)红曲霉属(Monascus van Tieghem)中的红曲红曲霉(Monascus anka Nakazawa et Sato)、紫红红曲霉(Monascus purpureus Went)、变红红曲霉(Monascus Serorubosens Seto)和马来加红曲霉(Monascus barkeri)等菌种,接种于蒸熟的大米,经培育所得。红曲霉是我国生产红曲米的主要菌种。
红曲色素是红曲霉菌丝产生的色素,含有六种不同的成分。其中红色色素、黄色色素和紫色色素各两种。它们的化学结构如图9-38所示。
图9-38 红曲米色素的结构
上述六种色素成分的物理化学性质互不相同(表9-9),实际应用的主要是醇溶性的红色色素红斑素和红曲红素。
表9-9 醇溶性结晶状红色色素红曲红素及红斑素的物理化学性质
1.制法
红曲米系将米(灿米或糯米)以水浸泡,蒸熟,加红曲霉(种曲)发酵制成。
红曲色素可将红曲用乙醇抽提,得液体红曲红色色素,或者自红曲霉的深层培养液中进一步结晶精制而得。
2.性状
红曲米为整粒米或不规则形的碎米,外表呈棕紫红色,质轻脆,断面为粉红色,无虫蛀及霉变,微有酸气,味淡,易溶于氯仿呈红色,溶于热水及酸、碱溶液,微溶于石油醚呈黄色,溶于苯中呈橘黄色。
红曲色素与其他食用天然色素相比,具有以下特点:
(1)对pH稳定,色调不像其他天然色素那样易随pH的改变而发生显著变化。其水提取液在pH11时呈橙色,pH12时呈黄色,pH极度上升则变色。其乙醇提取液在pH11时仍保持稳定的红色;
(2)耐热性强,虽加热到100℃也非常稳定,几乎不发生色调的变化,加热到120℃以上亦相当稳定;
(3)耐光性强,醇溶性的红色色素对紫外线相当稳定,但在太阳光直射下则可看到色度降低;
(4)几乎不受金属离子如0.01mol/L的Ca2+、Mg2+、Fe2+、Cu2+等的影响;
(5)几乎不受氧化剂和还原剂如0.1%的过氧化氢、维生素C、亚硫酸钠等的影响;
(6)对蛋白质的染着性很好,一旦染着后经水洗也不褪色。
(1)胭脂红提取物 由胭脂树种子提取制备而成,几种食用级溶剂可用于提取。超临界二氧化碳萃取技术是常规有机溶剂萃取的替代方法。从提取法得到的胭脂红中的主要色素为类胡萝卜素胭脂树素,胭脂树素中的甲酯基团经皂化水解,得到的二羧酸称为降胭脂树素(图9-39)。胭脂树素与降胭脂树素的溶解度不同,并可相应成为油溶及水溶性胭脂色素的基料。
图9-39 自胭脂树素形成降胭脂树素
(2)脱水甜菜 由可食全甜菜中的汁液脱水加工制成,存在于甜菜中的色素为甜菜色素[β-矢车菊色素(红色)和β-叶黄素(黄色)]。β-矢车菊色素与β-叶黄素两者的比例随甜菜的品种与成熟期而异。
(3)角黄素(β-胡萝卜素-4,4′-二酮)、β-阿朴-8′-胡萝卜醛及β-胡萝卜素为合成色素并可视为“天然类似物”,此类物质的结构见图9-40。
图9-40 类胡萝卜素“天然类似物”的结构式
(4)胭脂虫红提取物 是萃取胭脂虫的水-酒精提取物的浓缩物。起染色作用的主要为胭脂红酸,即一种红色素(图9-41)。此类提取物含有2%~3%的胭脂红酸,也可制成胭脂红酸含量高达50%的着色剂,以上着色剂均可以商品名胭脂红色素出售。
图9-41 胭脂红酸的结构式
(5)葡萄皮提取物 为红棕色液体,它从葡萄经压榨去汁后残留的果渣中提取制备获得。该提取物的着色物质主要由花青素组成,只限用于非碳酸及碳酸饮料、饮料配制基料和酒精饮料的着色。
(6)葡萄皮色素 是一种提自康科特紫葡萄的花青素色素的水溶液,或者是一种脱水的水溶性粉末,该提取物可被用于给非饮料型食物着色。
(7)果汁与蔬菜汁 是可接受的色素添加剂,它们能以单倍浓度或浓缩液的形式添加于食品中。与葡萄皮提取物不同,葡萄汁浓缩液可用于非饮料类食品。
(8)胡萝卜油 由己烷萃取自食用胡萝卜,然后经真空蒸馏除去己烷。该色素主要含α-和β-胡萝卜素,并有少量存在于胡萝卜中的其他类胡萝卜素。
(9)红辣椒粉或红辣椒油 是将红辣椒荚干燥粉碎或用溶剂提取的。在生产辣椒油过程中,可能会使用到多种溶剂,红辣椒色素的主要成分为辣椒黄素,即一种类胡萝卜素。
(10)核黄素或维生素B2为一种橙黄色粉末,它是牛奶中的天然色素。
(11)藏红花色素 是藏红花的干花柱头,其黄色呈色物为藏红素,即藏红酸的二糖苷。
(12)姜黄粉和姜黄油 分别为姜黄的根茎粉状物或提取物,其呈色物为姜黄素,在姜黄油的提取过程中可能会用到多种有机溶剂。
(13)其他天然色素 包括虾青素、群青、苏木藻色素、氧化铁、海藻干粉、万寿菊粉及玉米胚油、法夫酵母等。有些色素只限在动物饲料中使用,但它们也可间接地影响食品的颜色。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




