蛋白质的天然结构是各种吸引和推斥相互作用的净结果,这些相互作用源自于各种分子内作用力以及蛋白质的不同基团与周围水分子间的相互作用。一个蛋白质分子的天然态是在生理条件下热力学最稳定的状态。蛋白质所处的环境,例如:pH、离子强度、温度、溶剂组成等发生任何的变化都会迫使蛋白质分子采取一个新的平衡结构。
在某些理化因素的作用下,蛋白质的空间结构发生改变,即蛋白质的二级结构、三级结构和四级结构发生变化(不涉及主链上肽键的断裂),从而引起蛋白质的理化性质和生物活性发生变化,这种现象称为蛋白质的变性。蛋白质变性时,维系其空间结构的次级键遭到破坏,原有的空间结构解体,蛋白质肽链调整其结构以适应新的环境。在弱变性条件下,蛋白质部分变性,肽链保持一定的结构;在强变性条件下,蛋白质完全变性,有秩序的螺旋型、球状构象变为无规则的伸展肽链。
许多具有生物活性的蛋白质在变性时失去活性。食品蛋白质在变性时通常不再溶解并丧失某些功能性质。然而,在某些情况下,蛋白质的变性是期望发生的。例如,豆类中胰蛋白酶抑制剂的热变性能显著提高某些动物食用豆类蛋白质时的消化率和生物有效性。部分变性的蛋白质比起天然蛋白质更易消化和具有较好起泡性质和乳化性质。热变性也是热凝结形成蛋白质凝胶的先决条件。蛋白质变性时它的固有黏度提高而结晶能力丧失。
蛋白质变性是蛋白质从生理条件下的折叠结构转变成非生理条件下的展开态结构的现象。由于结构不是一个易于定量的参数,因此直接测定溶液中天然蛋白质和变性蛋白质所占的分数是不可能的。然而,蛋白质构象的变化必定会影响到蛋白质的某些化学和物理性质,例如紫外(UV)吸光度、荧光、黏度、沉降系数、旋光性、圆二色性、巯基反应能力和酶活力。因此,可以通过测定这些物理和化学性质的变化来研究蛋白质变性。
图5-9 典型的蛋白质变性曲线
Y—随蛋白质构象而变化的任何可测定的蛋白质分子的物理和化学性质
Y N和YD—分别代表蛋白质分子在天然和变性状态时的Y
考察蛋白质的某种物理或化学性质Y随变性剂浓度或温度等的变化来获得蛋白质的变性曲线。许多单体球状蛋白质的变性曲线如图5-9所示,YN和YD分别代表在蛋白质天然态和变性态时的Y。
对于大多数蛋白质,当变性剂的浓度(或温度)提高时,Y在起始阶段保持不变,在超过一个临界点后,此值在一个狭窄的变性剂浓度或温度范围从YN急剧变化至YD。对于大多数单体球状蛋白质,此转变曲线是陡峭的,这表明蛋白质变性是一个协同过程。一旦蛋白质分子开始展开或蛋白质分子中一些相互作用开始破坏,随后在变性剂的浓度或温度稍微提高时,整个分子完全展开。因此,可以认为球状蛋白质能以天然态或变性态存在,而以中间状态存在是不可能的,这就是所谓的“二态转变”模型。在此模型中,天然态和变性态在协同转变区的平衡可用式(5-3)表示:
式中 KD—平衡常数。
由于当不存在变性剂(或临界热量输入)时变性蛋白质分子的浓度非常低(约1/109),因此,很难估计出KD。然而,在转变区,即当变性剂的浓度充分高(或温度充分高)时,由于变性蛋白质分子数目的增加使得测定表观平衡常数Kapp成为可能。在转变区同时存在天然和变性蛋白质分子,Y可用式(5-4)表示。
式中 fN,fD—分别是天然态和变性态蛋白质所占的分数;
YN,YD—分别是天然态和变性态蛋白质的Y。
根据图5-9可以得到下式:
表观平衡常数可根据下式计算
而变性自由能可根据下式计算
蛋白质在纯水(或在不含变性剂的缓冲液)中的KD和ΔGD可以从Y-截距计算。变性的热焓ΔHD可以根据Van't Hoff方程式计算
含有两个或更多个结构稳定性不同的结构区域的单体蛋白质通常具有多步转变的变性特点。如果各步转变能彼此分开,那么可以从两状态模型的转变图得到各个结构区域的稳定性。低聚蛋白质的变性是从亚基离解接着亚基变性而完成的。
蛋白质变性在某些情况下是可逆的,当从蛋白质溶液中除去变性剂(或者将试样冷却)时,大多数单体蛋白质(不存在聚集)在适宜的条件(包括pH、离子强度、氧化还原电位和蛋白质浓度)下能重新折叠成天然构象。许多蛋白质当它们的浓度低于1μmo1/L时能重新折叠,当浓度超过1μmol/L时,由于较高程度的分子间相互作用而削弱了分子内相互作用,使重新折叠受到部分的抑制。如果蛋白质溶液的氧化还原电位接近生理液体的氧化还原电位,那么在重新折叠时有助于形成正确的二硫键对。
(一)物理因素
1.热与蛋白质变性
在食品加工和保藏过程中热处理是最常用的加工方法。在热加工过程中蛋白质产生不同程度的变性,这会改变它们在食品中的功能性质,因此了解热(或温度)如何导致蛋白质变性是很重要的。
当一个蛋白质溶液被逐渐加热并超过临界温度时,它产生了从天然态至变性态的剧烈转变。在此转变中点的温度被称为熔化温度Tm或变性温度Td,在此温度蛋白质的天然态和变性态的浓度之比为1。
温度导致蛋白质变性的机制是非常复杂的,它主要涉及非共价相互作用的去稳定化。氢键、静电和范德华相互作用具有放热的性质(热焓驱动),因此,它们在高温下去稳定而在低温下稳定。然而,由于蛋白质分子中的氢键大多数埋藏在分子的内部,因此在一个宽广的温度范围内能保持稳定。另一方面,疏水相互作用是吸热的(熵驱动)。在稳定蛋白质结构的作用力中,疏水相互作用是唯一一个随温度升高而增强的作用力。然而,疏水相互作用的稳定性也不会随温度的升高而无限制增强,这是因为超过一定温度,水的结构逐渐分裂最终也导致疏水相互作用去稳定。疏水相互作用在70~80℃时达到最高。因此,可以设想,当随温度提高而逐渐增强的疏水相互作用所产生的稳定效力被其他相互作用的破坏所克服时,就产生了蛋白质的热变性。图5-10解释了热如何促进疏水相互作用。
另一个影响蛋白质构象稳定性的重要作用力是多肽链的构象熵,即-TΔSconf这一项。随着温度的升高,多肽链热动能的增加极大地促进了多肽链的展开。图5-11描述了氢键、疏水相互作用和构象熵这3个主要作用力对蛋白质稳定性的相对贡献与温度的关系。在温度升高的过程中氢键保持不变而疏水相互作用增强。然而,在较高的温度下这两种作用力被构象熵的去稳定作用力压倒(-TΔSconf是一个大的负值,使ΔGD=ΔHD-TΔSD成为负值)。自由能的总和为0(即KD=1)时的温度为蛋白质的变性温度Td,表5-9所示为某些蛋白质的变性温度,表中同时列出了一些蛋白质的平均疏水性数据。
图5-10 加热促进疏水相互作用
图5-11 氢键、疏水相互作用和构象熵对稳定蛋白质自由能所作的贡献随温度的变化情况
表5-9 某些蛋白质的热变性温度(Td)和平均疏水性
续表
一般认为,温度越低,蛋白质的稳定性越高。然而,实际情况并非总是如此。如图5-12中看出核糖核酸酶A的稳定性随温度下降而提高,而肌红蛋白和T4噬菌体突变株溶菌酶分别在30℃和12.5℃时显示最高的稳定性,低于或高于这些温度时肌红蛋白和T4溶菌酶的稳定性较低。当保藏温度低于0℃时,这两种蛋白质遭受冷诱导变性。蛋白质显示最高稳定性的温度(最低自由能)取决于温度对蛋白质分子相互作用力的影响。如果蛋白质的稳定主要依靠疏水相互作用,那么它在室温时比在冷藏温度时更为稳定。
图5-12 蛋白质的稳定性(ΔGD)随温度而变化
…肌红蛋白;—核糖核酸酶A;。。。T4噬菌体突变株溶菌酶;K-平衡常数
一些食品蛋白质在低温下会经受可逆离解和变性。大豆中一种贮藏蛋白质—大豆球蛋白在2℃保藏时产生聚集和沉淀,而当温度回升至室温时,它再次溶解。脱脂牛乳在4℃保藏时,β-酪蛋白会从酪蛋白胶团中离解出来,这就改变了胶团的物理化学和凝乳性质。一些寡聚体酶,例如乳酸脱氢酶和甘油醛磷酸脱氢酶在4℃保藏时失去大部分酶活,其原因就是亚基的离解。然而,将上述酶在室温下保温数小时后,它们重新缔合并且完全恢复其酶活。
蛋白质的热稳定性受氨基酸组成的影响。含有较高比例疏水性氨基酸残基(尤其是Val、Ile、Leu和Phe)的蛋白质比亲水性较强的蛋白质一般更为稳定。耐热生物体的蛋白质通常含有大量的疏水性氨基酸。然而,蛋白质的平均疏水性和热变性温度之间的这种正相关仅仅是一个近似,其他因素,像二硫键和埋藏在疏水区的盐桥对蛋白质的热稳定性可能也有着贡献。蛋白质的热稳定性和某些氨基酸残基的含量存在正的相关性。例如对15种不同蛋白质进行统计学分析发现,这些蛋白质的热变性温度与Asp、Cys、Glu、Lys、Arg、Trp和Tyr残基的总含量呈正相关(r=0.98),而与Ala、Asp、Gly、Gln、Ser、Thr、Val和Tyr残基的总含量呈负相关(r=-0.975)(图5-13)。其他氨基酸残基对蛋白质的Td影响甚少。然而,蛋白质的热稳定性似乎不完全取决于极性或非极性氨基酸残基的含量,它还取决于这两类氨基酸残基在蛋白质结构中的最佳分布。这种最佳分布能使分子内的相互作用达到最优,从而降低了多肽链的柔性,提高了蛋白质的热稳定性。蛋白质的热稳定性与柔性呈反比。
单体球状蛋白质的热变性在大多数情况下是可逆的。例如,当许多单体酶被加热至超过它们的变性温度时,甚至在100℃保持短时间,然后立即冷却至室温,它们能完全复活。然而,当蛋白质被加热至90~100℃并保持一段较长的时间,即使在中性pH它们也会产生不可逆变性。产生不可逆变性的原因可能是蛋白质分子发生了化学变化,例如Asn和Gln残基的去酰胺作用,Asp残基处肽键的断裂,Cys和胱氨酸残基的破坏以及聚集作用等。
水能促进蛋白质的热变性。干蛋白质粉一般不容易发生热变性。当水分含量从0.1g水/g蛋白质增加至0.35g水/g蛋白质时,Td快速下降(图5-14),水分含量继续从0.35g水/g蛋白质增加至0.75g水/g蛋白质时,Td仅略微下降。当水分含量超过0.75g水/g蛋白质,蛋白质的Td与稀蛋白质溶液相同。水合作用对蛋白质热稳定性的影响基本上与蛋白质的动力学有关。在干燥状态,蛋白质具有静止的结构,或者说多肽链段的移动受到了限制。当水分含量增加时,水合作用以及水的部分渗透导致蛋白质的溶胀。在室温下,当水分含量为0.3~0.4g/g蛋白质时,蛋白质的溶胀状态达到最高值。蛋白质的溶胀增加了多肽链的移动性和柔性,使蛋白质分子可以呈现动态的熔融结构,当加热时,这种柔性结构能提供给水更多的机会参与形成盐桥和氢键,从而降低Td。
图5-13 氨基酸残基与球状蛋白质热稳定性的相关性(https://www.xing528.com)
X1组代表Asp、Cys、Glu、Lys、Leu、Arg、Trp和Tyr
X2组代表Ala、Asp、Gly、Gln、Ser、Thr、Val和Tyr
图5-14 水分含量对卵白蛋白的变性温度(Td)和热焓(ΔHD)的影响
一些添加剂如盐和糖会影响蛋白质在水溶液中的热稳定性。糖类物质如蔗糖、乳糖、葡萄糖等,能提高蛋白质的热稳定性。在β-乳球蛋白、大豆蛋白、血清清蛋白和燕麦球蛋白等蛋白质溶液中添加0.5mol/L NaCl能显著提高它们的变性温度Td。
2.静水压和变性
静水压是影响蛋白质构象的一个热力学参数。温度诱导的蛋白质变性一般发生在40~80℃(0.1MPa);而压力诱导的变性可在25℃发生,条件是必须有充分高的压力存在。从光谱数据证实,大多数蛋白质在100~1200MPa经受压力诱导变性。压力诱导转变的中点出现在400~800MPa。
压力诱导蛋白质变性主要是因为蛋白质是柔性的且可压缩的。虽然氨基酸残基紧密地包裹在球状蛋白质分子结构的内部,但是仍然存在一些空穴,这就导致蛋白质分子结构的可压缩性。大多数纤维状蛋白质不存在空穴,因此它们对静水压作用的稳定性高于球状蛋白质。
压力诱导的球状蛋白质变性通常伴随着体积的减少,约30~100mL/mol。在压力作用下,如果球状蛋白质完全展开,体积应减少2%。然而,根据实验数据30~100mL/mol计算相当于体积减少约0.5%;这表明即使在高达1000MPa压力作用下,蛋白质也仅仅是部分地展开。
压力诱导的蛋白质变性是高度可逆的。一旦压力恢复至常压(0.1MPa),大多数酶(在稀溶液中)的酶活力能复原或再生。然而,酶活力的完全恢复常常需要几个小时。压力诱导低聚蛋白质和酶变性时,在0.1~200MPa压力下,首先发生亚基的解离,继而在更高的压力下变性;当除去压力作用时,亚基重新缔合,在几小时内酶活几乎完全恢复。
高静水压可作为食品加工的一种手段,例如应用于灭菌或者蛋白质的凝胶。由于高静水压(200~1000MPa)不可逆地破坏细胞膜和导致微生物中细胞器的离解,这样就使生长着的微生物死亡。在25℃,对蛋清、16%大豆蛋白质溶液或3%肌动球蛋白溶液施加100~700MPa静水压处理30min就能产生压力胶凝作用。压力诱导的凝胶比热诱导的凝胶更软。用100~300MPa静水压处理牛肉肌肉,能导致肌纤维部分地碎裂,这也许可以作为使肉嫩化的一种手段。压力加工不同于热加工,它不会损害蛋白质中的必需氨基酸或天然色泽和风味,也不会导致有毒化合物的形成。可见,除成本之外,采用静水压加工食品有诸多优点。
3.剪切和变性
由振动、捏和、打擦产生的机械剪切能导致蛋白质变性。许多蛋白质当被激烈搅动时产生变性和沉淀。蛋白质剪切变性是由于空气泡的并入和蛋白质分子吸附至气-液界面。由于气-液界面的能量高于体相的能量,因此蛋白质在界面上经受构象变化。蛋白质在界面构象变化的程度取决于蛋白质的柔性。高柔性的蛋白质比刚性蛋白质较易在气-液界面变性。蛋白质分子在气-液界面变性时,非极性残基定向至气相而极性残基定向至水相。
食品加工单元操作如挤压、高速搅拌和均质等能产生高压、高剪切和高温。当一个转动的叶片产生高剪切时,产生亚音速的脉冲,在叶片的尾随边缘也出现空化,这两者都能导致蛋白质变性。剪切速度愈高,蛋白质变性程度愈高。高温和高剪切力相结合能导致蛋白质不可逆的变性。例如,在pH3.5~4.5和温度80~120℃条件下用7500~10000s-1的剪切速度处理10%~20%乳清蛋白溶液能形成直径约1μm的不溶解的球状大胶体粒子。一种具有润滑、乳状液口感的脂肪代用品“Simplesse”就是用该法制备的。
4.辐照和变性
电磁射线对蛋白质的影响随波长和能量而变化。芳香族氨基酸残基(Trp、Tyr和Phe)能吸收紫外线;如果紫外线的能量水平足够高,那么就能打断二硫键交联,从而导致蛋白质构象的改变。γ射线和其他离子射线也能导致蛋白质构象的改变,与此同时产生的变化有氨基酸残基氧化、共价键断裂、离子化、形成蛋白质自由基以及重新结合和聚合反应。上述反应中的许多反应是以水的辐照裂解为媒介的。FDA和WHO有关辐照食品卫生的联合专家委员会已批准离子辐射可用于某些食品的保藏。许多研究工作表明,在合适的条件下,离子辐射不会对蛋白质的营养质量产生明显的损害作用。例如,在-5~-40℃采用4.7万~7.1万Gy/剂量辐照牛肉时牛肉蛋白的氨基酸残基没有变化。然而,某些食品产品对辐照非常敏感,牛乳就是其中之一,在辐照剂量低于灭菌所需的水平时就能导致牛乳产生不良风味。从经辐射的脱脂乳和酪蛋白酸钠溶液中检出甲基硫化物,这显然与蛋白质分子中含硫氨基酸残基的变化有关。因此,如果辐照仅引起蛋白质构象的改变,那么不会显著影响蛋白质的营养质量;如果辐照导致蛋白质分子中氨基酸残基的变化,那么就必须考虑蛋白质的营养质量受到了损害。
(二)化学因素
1.pH和变性
蛋白质在等电点时与非等电点pH相比,更不容易发生变性。由于大多数蛋白质的pI低于7(表5-10),因此在中性pH它们带有负电荷。仅有少数蛋白质带有正电荷。
表5-10 几种重要食品蛋白质的等电点(pI)
由于在中性pH附近,净静电推斥能量小于其他稳定蛋白质的相互作用的能量,因此大多数蛋白质是稳定的。然而,在极端pH,高净电荷引起的强烈的分子静电推斥导致蛋白质分子的肿胀和展开。在极端碱性pH时蛋白质分子展开的程度高于其在极端酸性pH时的展开程度。在极端碱性pH时,部分埋藏在蛋白质分子内部的羧基、酚羟基和巯基离子化,这些离子化基团倾向于将自己暴露至水环境中,因此造成多肽链的展开。pH诱导的蛋白质变性多数是可逆的。然而,在某些情况下,肽键的水解,Asn和Gln的脱酰胺,在碱性pH巯基的破坏或聚集作用能导致蛋白质的不可逆变性。
2.有机溶质和变性
有机溶质如尿素和盐酸胍(GuHCl)会引起蛋白质的变性。对于许多球状蛋白质,在室温条件下从天然态转变至变性态的中点出现在4~6mol/L尿素或者3~4mol/L GuHCl,完全转变则常常出现在8mol/L尿素和约6mol/L GuHCl,由于GuHCl具有离子的性质,因此与尿素相比,它是更强的变性剂。有的球状蛋白质即使在8mol/L尿素中仍然不会完全变性,但在8mol/L GuHCl中它们通常以无规卷曲状态(完全变性)存在。
尿素和GuHCl造成的蛋白质变性包括两个机制。第一个机制是尿素或GuHCl与变性蛋白质优先结合,由于变性蛋白质以蛋白质-变性剂复合物的形式存在,N→D平衡向右移动。随着变性剂浓度的增加,蛋白质继续不断地转变成蛋白质-变性剂复合物,最终导致蛋白质的完全变性。由于变性剂与变性蛋白质的结合是很微弱的,因此,只有高浓度的变性剂才能导致蛋白质完全变性。
第二个机制是疏水性氨基酸残基在尿素和GuHCl溶液中的增溶。由于尿素和GuHCl具有形成氢键的能力,因此在高浓度时这些溶质破坏了水的氢键结构。作为极性溶剂的水在结构遭到破坏后,成为非极性残基的较好溶剂,这就导致蛋白质分子内部的非极性残基的展开和增溶。一些平均疏水性较高的蛋白质,如酪蛋白,它的水解产物肽易于缔合,在采用凝胶过滤色谱分离这些水解产物时,常使用高浓度的尿素以防止它们的缔合,这时尿素的作用也涉及它对肽中非极性残基的增溶。
尿素或GuHCl诱导的蛋白质变性在除去变性剂后可以逆转。然而,由尿素诱导的蛋白质变性要实现完全的可逆有时是困难的,这是因为一部分尿素转变成氰酸盐和氨,而氰酸盐能与氨基作用从而改变了蛋白质的电荷。
3.表面活性剂和变性
表面活性剂,如十二烷基硫酸钠(SDS),是强有力的变性剂。SDS浓度为3~8mmol/L就能使大多数球状蛋白质变性。表面活性剂的作用如同蛋白质疏水区和亲水环境的媒介物,于是破坏了疏水相互作用从而使得天然蛋白质结构展开。不同于尿素和GuHCl,SDS能同变性蛋白质分子强烈地结合,并使它带有很大的负电荷,这也是SDS能在较低的浓度下使蛋白质完全变性的原因。由于存在着这种强烈的结合,因此,SDS诱导的蛋白质变性是不可逆的。球状蛋白质经SDS变性后不是以随机线圈状态存在,而是在SDS溶液中采取α-螺旋棒状形式存在。
4.有机溶剂和变性
有机溶剂以不同的方式影响着蛋白质的疏水相互作用、氢键和静电相互作用。大多数有机溶剂被认为是蛋白质的变性剂。与水互溶的有机溶剂,如乙醇和丙酮,会改变介质(水)的介电常数,从而改变了稳定蛋白质结构的静电力。非极性溶剂能穿透到蛋白质疏水区,削弱疏水相互作用,从而导致蛋白质变性。有机溶剂与水的相互作用也是导致蛋白质变性的一个原因。
以脱脂大豆粉为原料,采用水-乙醇混合物分离其中的可溶性碳水化合物(低聚糖)和无机盐以制备大豆浓缩蛋白。按此法得到的大豆浓缩蛋白的溶解度一般偏低,这主要是由于有机溶剂乙醇使部分大豆蛋白质变性的缘故。在低温下操作可以减轻或避免有机溶剂造成的蛋白质变性。
5.促溶盐(Chaotropic Salts)和变性
盐以两种不同的方式影响蛋白质的稳定性。在低浓度时,离子通过非特异性的静电相互作用与蛋白质作用。此类蛋白质电荷的静电中和一般稳定了蛋白质的结构。完全的电荷中和出现在离子强度等于或低于0.2,并且与盐的性质无关。然而在较高的浓度(>1mol/L),盐对蛋白质的结构稳定性具有离子的特异性。Na2SO4和NaF有利于蛋白质结构的稳定性,而NaSCN和NaClO4的作用则相反。阴离子对蛋白质结构的影响强于阳离子。图5-15为各种钠盐对β-乳球蛋白热变性温度的影响。在相同的离子强度,Na2SO4和NaCl使Td提高,而NaSCN和NaClO4使Td降低。大分子(包括DNA)不论化学组成和构象差异,高浓度的盐总是对它们的结构稳定性产生不利的影响。NaSCN和NaClO4是强变性剂。在等离子强度,各种阴离子影响蛋白质(包括DNA)的结构稳定性的能力一般遵循下列顺序:F-<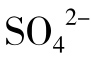 <Cl-<Br-<I-<
<Cl-<Br-<I-<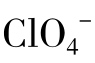 <SCN-<C13CCOO-。这个等级排列也被称为Hofmeister系列或促溶(Chaotropic)系列。氟化物、氯化物和硫酸盐是结构稳定剂,而其他阴离子盐是结构去稳定剂。
<SCN-<C13CCOO-。这个等级排列也被称为Hofmeister系列或促溶(Chaotropic)系列。氟化物、氯化物和硫酸盐是结构稳定剂,而其他阴离子盐是结构去稳定剂。
图5-15 各种盐对β-乳球蛋白在pH7.0时变性温度Td的影响
○Na2SO4ΔNaCl □NaBr ●NaClO4▲NaSCN ■脲素
盐影响蛋白质结构稳定性的机制和其与蛋白质的结合能力以及对蛋白质的水合性质的改变有关。稳定蛋白质的盐能促进蛋白质的水合并与蛋白质微弱地结合,而使蛋白质不稳定的盐能降低蛋白质的水合并与蛋白质强烈地结合。这些效应主要是在蛋白质-水界面上能量扰动的结果。从更为基础的水平来看,盐类导致蛋白质的稳定和去稳定与它们对体相水的结构的影响有关。稳定蛋白质结构的盐能促进水的氢键结构,使蛋白质变性的盐则能破坏体相水的结构,使水成为非极性分子较好的溶剂。换言之,促溶盐的变性效应或许与蛋白质分子中疏水相互作用的去稳定有关。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




