蓄电池从外电路接受电能转化为化学能的过程称为充电(charge)。蓄电池在其能量经放电(discharge)消耗后,通过充电得以恢复,又能重新放电,构成充放(电)循环。一般用直流电流充电。近几十年出现并不断改进的快速充电是正向的直流电流间杂有反向的脉冲电流。也有用不对称交流电流或脉冲电流充电的。
充电时,蓄电池的正极接充电机输出正端,这时它是阳极,其过电位也是正值,使电极电位趋正(升高);蓄电池的负极接充电机输出负端,这时它是阴极,其过电位为负值,使电极电位趋负(降低)。和放电的情况不同,充电时没有极限扩散电流值。充电开始时,或大或小地出现一个电压峰值。这是由于在电极表面生成的PbSO4引起的欧姆极化造成的。
充电期间,在两极发生的电化学反应可以简单地表示为
在正极PbSO4+2H2O-2e=PbO2+HSO4-+3H+ (10-1)
H2O-2e=2H++1/2O2 (10-2)
在负极PbSO4+H++2e=Pb+HSO4- (10-3)
2H++2e=H2 (10-4)式(10-1)和式(10-3)是铅酸蓄电池的充电反应,而式(10-2)和式(10-4)是析出气体的副反应。在充电过程中,充电反应进行到一定程度,生成一部分PbO2和Pb之后,就会在正极析出氧,在负极析出氢。气体的析出决定于析出过电位。就热力学而言,两种气体分别在正极和负极上析出的反应优先于充电反应。从电化学动力学的角度看,析出气体受到强烈阻碍,以致析气反应和充电反应同时发生甚至滞后于充电反应。这当然有利于充电的进行。然而在极化较强烈时,转变活性物质的充电反应会受到抑制,例如充电电流密度较大或者一些结构较特殊的蓄电池。有些情况下,例如在负极上有Sb或痕量的铂Pt,气体析出受到的抑制将会消除,充电电流的大部分用于析出气体。
充电电流一部分用于充电反应,另一部分消耗于析气(或其它副反应)。为了表明充电的效率,这里引入充电接受能力(charge acceptance)这一概念。充电接受能力定义为充电时用于活性物质转化的电流(一段时间为电量)与所消耗的总电流(一段时间为总电量)之比。充电效率(charge efficiency)即安时效率(ampere-hour efficiency)是在规定条件下,蓄电池放电给出的电量与通过充电恢复到初始的完全充电状态所需电量之比。各国蓄电池的技术标准中的充电接受能力的技术指标是一项具体的要求,蓄电池应在规定的条件下达到一定的充电电流值,和这里所说的有所不同。安时效率的倒数叫充电系数(charge factor),它总是大于1。蓄电池放出能量与通过充电恢复到完全充电状态所需能量之比叫做能量效率(energy efficiency)或瓦时效率(watt-hour efficiency;w·h efficiency)。
蓄电池的充电接受能力依赖于自身的一些条件如结构(板栅材料、活性物质与添加剂等)、新旧程度、前次的放电深度和外界条件如温度、充电条件等。决定充电接受能力的是电化学动力学而不是电化学热力学。蓄电池充电的电极反应在很大程度上是可逆的,过电位并不大,而析出气体的反应则是不可逆的,有较大的过电位。
有文献给出了充电接受能力依赖于温度和充电电流的函数关系【1】。负极板在25℃时的充电接受能力几乎是100%,随着温度的下降而下降,电流密度大则随温度较早地下降。如果不是很低的温度,如在0℃以上,正极板的充电接受能力下降的不多(图10-1)。图10-1的实验条件是,在实验温度下以不同的电流密度充电150A·h·m-2,约为蓄电池额定容量的一半。蓄电池极板的5h率容量为1A·h。放电电流密度为0.2A·片-1,相当于50A·m-2。电解液是过量的,密度为1.28kg·L-1。以Hg/Hg2SO4电极为参比电极。
在低温和大电流密度下,充电的电流效率较低。可以用溶解-沉淀理论对充电接受能力做些解释。
充电反应伴随着PbSO4的溶解和离解。充电时,在阴极Pb沉积在负极板上;阳极氧化生成的PbO2沉淀在正极板上。铅电极上的阴极反应受极限电流的限制【2】。在H2SO4溶液浓度3~5.5m(质量百分浓度22.7%~35.0%)范围内,极限电流的值与浓度无关。以极板表观面积即几何面积计,其值约为2000A·m-2。以内表面(internal surface)面积计约为1A·m-2。内表面面积指的是多孔电极的空腔内壁的面积,它在多孔电极的总面积中占有非常大的份额。如果取PbSO4在H2SO4溶液中的溶解度为5×10-9 mol·mL-1,由此可以计算出扩散双电层(diffusion electric double layer)的厚度δ=1.5μm。这一数值远小于通常的扩散层厚度值。可以得出结论,铅离子Pb2+是在紧靠着铅电极的表面(约1μm处)的规则的扩散层中被还原的。这里是传质反应的相介面。这个扩散层和电极上重结晶形成的晶体的大小无关。在此区间,极限电流是不变的。溶解速率足够快,对于晶体的生长和充电时的极限电流所要求的保持一定的铅离子浓度来说都是足够的。放电之后,可以用显微镜看到重结晶的晶体。起初形成的PbSO4晶体的直径至多为1μm,结晶层的平均厚度约为0.5μm。8天后最大的晶体长至5μm,而5个月后则为10μm。
有机物例如负极活性物质中的膨胀剂和杂质抑制溶解速率。在这种情况下,极限电流减小。加入木素磺酸钠一类的物质会屏蔽反应表面,导致溶解速率降低,反过来这又导致极化,降低充电接受能力。在约300A·m-2时,电流密度-电压曲线接近塔菲尔方程。大于这个值,析出氢气颇为剧烈。这意味着充电接受能力小或者未进行充电反应。在溶液中加入络合剂EDTA,电流-过电位曲线变成一条析出氢气的塔菲尔直线,在电极上没有充电反应进行。
屏蔽剂(inhibitor)提高电极反应的过电位,降低充电接受能力。通常都用生成坚硬的PbSO4晶体来解释旧蓄电池的负极可充电性差、容量低的现象,实际上应当用屏蔽剂覆盖电极表面来解释这一现象。(https://www.xing528.com)
正极板在放电状态下贮存也会生成粗大的PbSO4晶体,但其可充电性并无任何降低。由于正极电位高,有机物在正极表面不会被吸附。
另外,如果负极板上有氢过电位较低的金属杂质存在,PbSO4电极被污染,氢的析出过电位会降低,充电接受能力可能降至很低。局部电池可能由于低过电位造成氢离子H+放电而析出氢。例如痕量的Pt就会阻碍负极充电反应的进行。其它金属的影响因其量的多少和沉积状态不同而不同,也或大或小的有类似作用,但不如Pt显著。这种作用不仅在充电时,而且在蓄电池开路搁置时也会发生。
温度影响PbSO4的溶解速率。在低温下溶解速率较低、难以维持饱和浓度。另外,在低温下,溶解度本身也较低。蓄电池充电过程中电解液的浓度范围约为3~5.5m,相应的PbSO4的溶解度仅降低约2/3,对极限电流几乎没有什么影响。从图10-1可以看到,充电接受能力随着温度的降低而降低。这是因为在低温下较低的铅离子浓度改变了可逆电位而且增加了浓差过电位。这两个原因导致气体较早析出。
从图10-1还可以看到,在相应的电流密度下,两种极性的极板的充电接受能力不同。但是,如果以电极的内表面面积来计算电流密度,那么正极板和负极板的充电接受能力就近似相等。在图10-1的实验条件下,对于正极来说,内表面面积约为表观几何面积的2×104倍,而对负极则为2×103倍。正极和负极的表观电流密度之比为i+∶i-=10∶1时,实际电流密度才相等。两种极性的极板在低温下的充电接受能力的差别就容易解释了。这和有关论述有共同之处【2,3】。
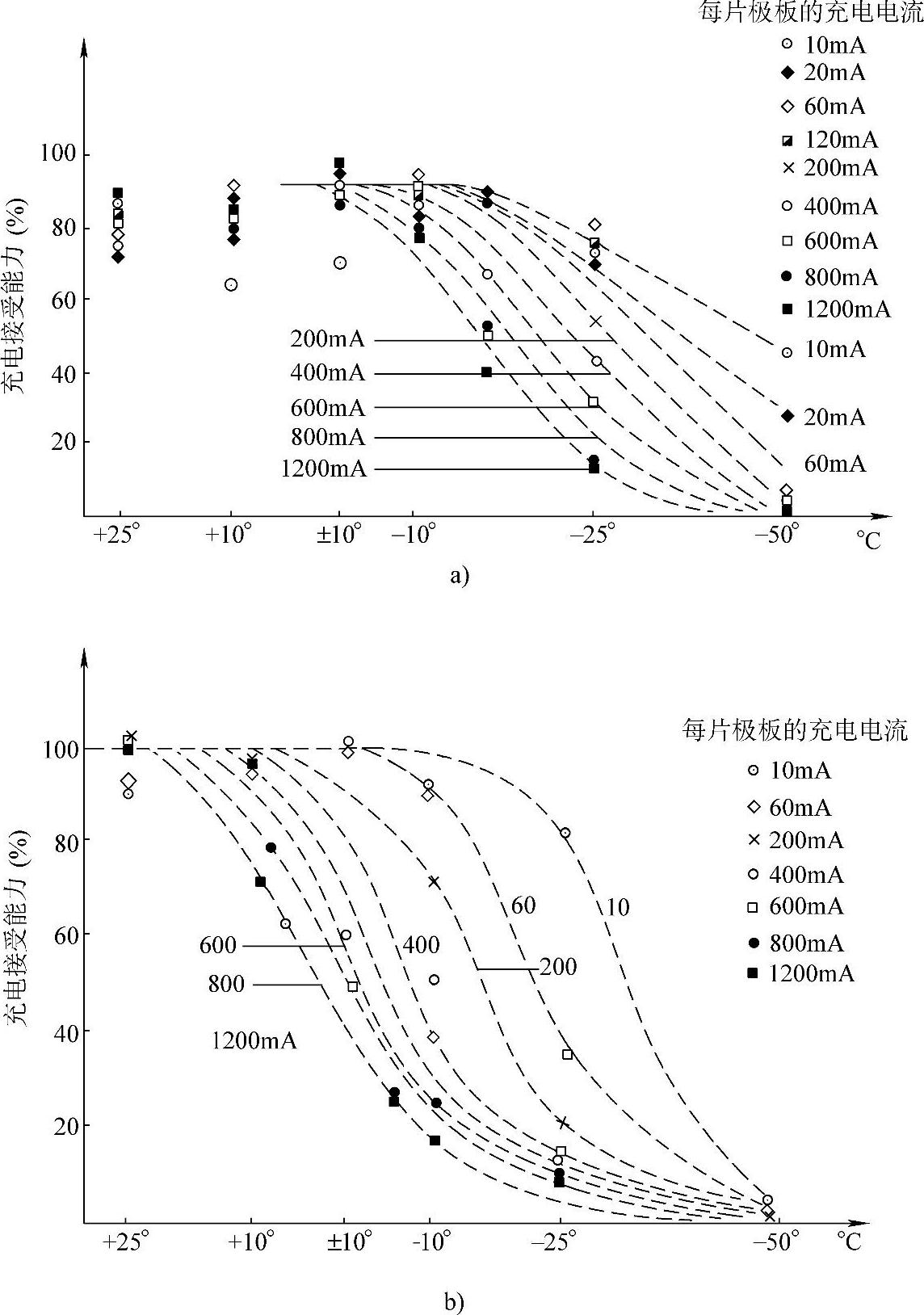
图10-1 蓄电池的充电接受能力对于电流密度和温度的函数关系
a)正极 b)负极
负极在室温下的充电接受能力几乎为100%,直至充电达到极板容量的一半左右。在0℃、在上述试验条件下,仅在大于5h率充电电流(200mA片-1)时才有明显下降。当温度更低时,小电流密度充电,充电接受能力也下降。在-50℃,无论多大的电流密度充电几乎都是不可能的,当负极电极电位低于-3V(相对于SHE)时,发生水的电解反应。
相反,在高于室温的温度下充电情况就不同了。此时正极的充电接受能力为100%,但正极的自放电速率也加快了,PbO2自发分解并产生氧气。这一过程不依赖于充电过程而独立进行,特别是在充电时间较长和充电电流密度较大的情况下更为显著。
威利汉根斯(E.Willihanganz)对于蓄电池在低温(-40℃)下正、负极的充电接受能力以及有机膨胀剂的影响做了研究【4】,有些理论和上述结论是一致的。
可以说,温度低、充电电流密度大,蓄电池的充电接受能力就低。15~45℃是合适的充电温度。
正、负极板的充电接受能力有不同的特点。当单体蓄电池的电压升至2.4V期间,负极板的充电接受能力接近1,随后很快降低至接近零,负极板几乎已经完全充电。正极板的充电接受能力在单体蓄电池的电压达到2.2V时就开始下降,然后再升再降,但不会趋近零【5】。在0~40℃,气体的析出主要依赖于充电电流密度,和温度的关系不大【6】。但在实践中,低温充电要求不析出(或很少析出)气体则需要延长充电时间。
如果没有其它副反应,充电时正、负极的电极反应如式(10-1)~式(10-4)所示。按照电解定律,两个正极反应的总电流与两个负极反应的总电流是相等的,即正极生成的二氧化铅摩尔(1PbO2)数与氧摩尔(1/2O2)数之和等于负极生成的金属铅摩尔(1Pb)数与氢摩尔(1H2)数之和。正、负极的充电反应,正、负极析出气体的反应都是各自独立的,二氧化铅与铅、氧与氢的摩尔数不一定相等。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




