化学电源在一定条件下保持其电荷不损失的能力即荷电保持能力(charge retention)。
蓄电池在开路搁置期间,其容量不断下降,这就是所谓自放电(self-discharge)现象。荷电保持是与自放电反义的一个概念。
如果开路搁置的时间间隔是Δt,蓄电池的容量变化是ΔC,用下式定义自放电系数Se:

当时间间隔趋近于零时,有

设Se只与蓄电池的结构和温度有关,而与搁置时间无关,即在一定温度下是一常数。当t=0时,蓄电池容量为C0,搁置时间为t时,蓄电池容量为Ct,则
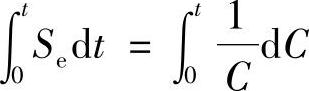
得到Se·t=lnCt-lnC0
即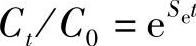 或
或 容量C是随搁置时间t而下降的,所以有
容量C是随搁置时间t而下降的,所以有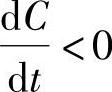 ,即Se<0。
,即Se<0。
引起自放电的原因很多。正极活性物质PbO2和负极活性物质海绵状Pb在硫酸溶液中处于热力学不稳定状态是一个重要原因。PbSO4/PbO2的电极电位比O2/H2O高约0.47V,而Pb/PbSO4比H2/H2O却低约0.36V。在开路搁置的情况,PbO2电极上析出氧,Pb电极上析出氢的反应是必然发生的。
PbO2电极上造成自放电的电极与电池反应是正极(阴极还原)PbO2+4H++SO2-4+2e=PbSO4+2H2O
(8-88)负极(阳极氧化)H2O-2e=2H++1/2O2(8-89)电池反应PbO2+2H++SO42-=PbSO4+H2O+1/2O2 (8-90)
这一反应的反应速率随着酸浓度的增加而增加【24-27】。图8-13表明了这一点。
从PbO2上析出氧的速率还受某些杂质的强烈影响。正板栅中的锑溶解后留在正极活性物质中使氧的析出加快。还有钴、银和铜的离子也能加速氧在PbO2上的析出【24,28,29】。
另外,PbO2与正板栅金属Pb或Sb反应也可以导致自放电,反应式如下:
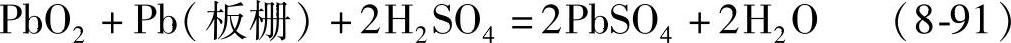
这一反应和蓄电池放电的反应是一样的。
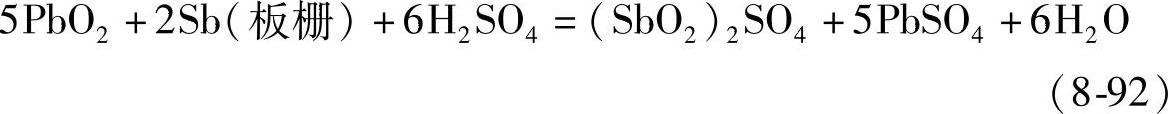
由式(8-90)的自放电反应引起的容量损失ΔC+(A·h),可由析出氧气(O2)的体积V(L)来计算,由反应式可知,2F(=2×26.80A·h)电量的损失,伴随着0.5mol氧(在标准状况下是11.2L)的析出。由此得出
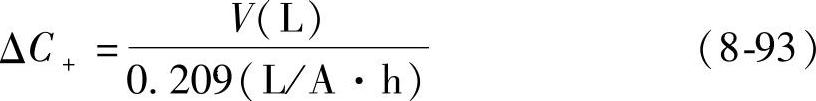
如果收集的氧气的温度为t℃,压强为p(Pa),体积为V′(O2),可以用下式把V′(O2)换算为标准状况下的体积V(O2):(https://www.xing528.com)
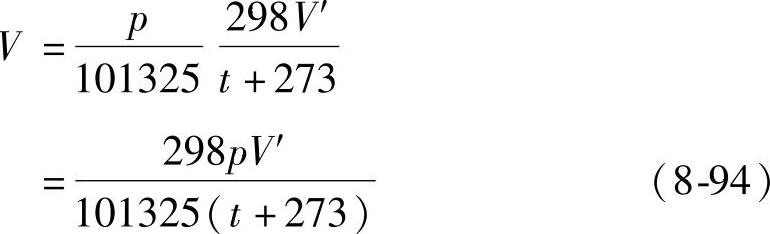
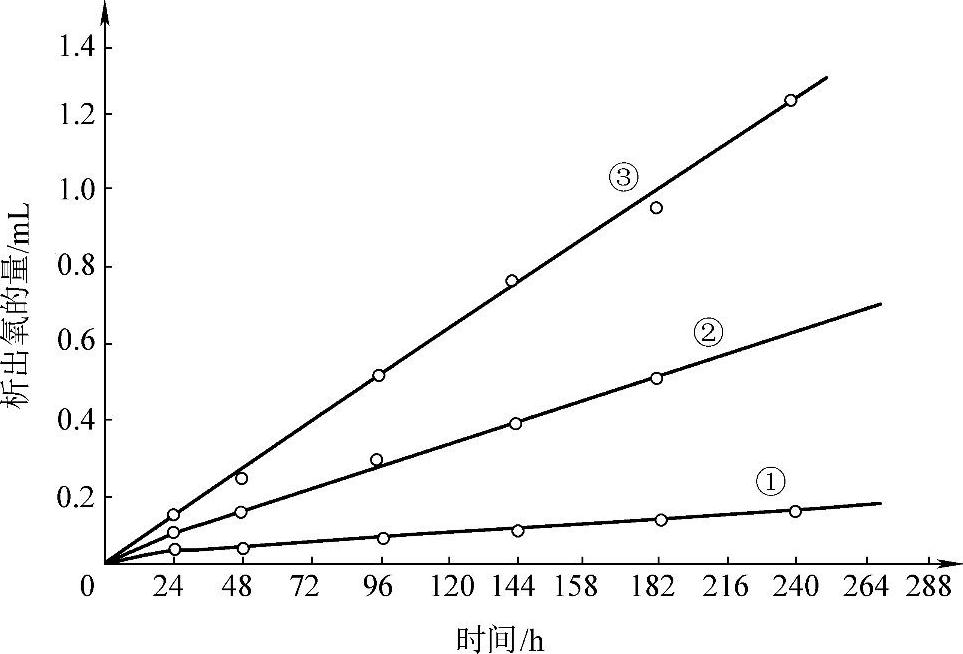
图8-13 从1.50g β-PbO2上析出氧的量与H2SO4溶液密度的关系(30℃)
①—H2 SO4溶液1.14kg·L-1 ②—H2 SO4溶液1.24kg·L-1 ③—H2 SO4溶液1.34kg·L-1
图8-14 表示蓄电池35℃开路搁置16个星期后经分析测定的正极活性物质中PbSO4的含量(质量%)【25】。图中曲线A表示没有板栅,活性物质单独浸在硫酸溶液中的情况。曲线B表示活性物质涂填在Pb-Sb4%的合金板栅上,曲线C表示板栅为Pb-Ca合金的情况。从图中曲线A和C的差别可以看出,由于活性物质与板栅之间的反应,在有板栅存在时,在H2SO4溶液密度较低的情况下,硫酸盐化(sulphation)的进程较快。在Pb-Sb4%板栅的情况下,硫酸盐化较快的原因是析出氧增加,在H2SO4溶液密度接近1.13kg·L-1达到最大值。在H2SO4溶液密度较低时,板栅与活性物质之间的反应速率慢慢降低。
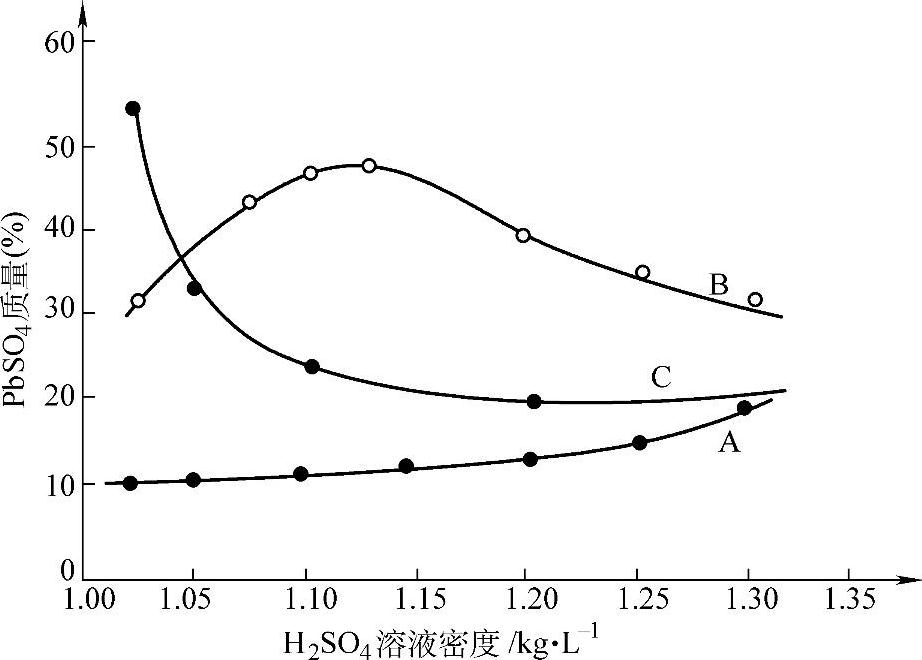
图8-14 极板或活性物质单独存在搁置后正极活性物质中PbSO4的质量百分含量
负极海绵状Pb的自放电反应可以按下式进行:
Pb+H2SO4=PbSO4+H2 (8-95)这一反应的速率随着H2SO4溶液浓度的增加而增加【25,30】。由于这一反应引起的容量损失ΔC-(A·h)可由析出氢气的体积V(L)来计算:
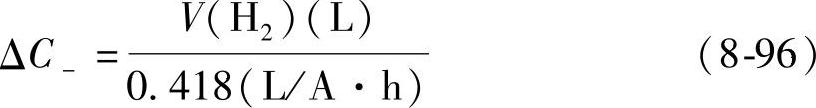
如果收集的氢气的温度为t℃,压强为p(Pa),体积为V′(H2),可用下式把V′(H2)换算为标准状况下的体积V(H2):
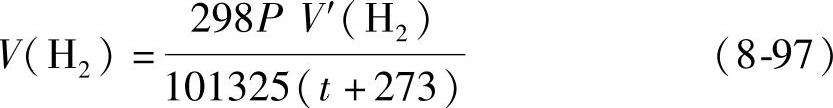
由于氢在铅上的析出过电位较大,在纯铅或Pb-Ca合金板栅上,这一反应的速率很慢。如果负极活性物质被锑污染,氢的析出就会相当快【25,28】。但是锑存在于正极活性物质中则是有益的。事实上,从正板栅上阳极溶解的锑的绝大部分仍然滞留在正极活性物质中,只是在以后才到达负极。
滞留的锑能够成为PbO2颗粒之间的连接剂。由于这种作用,正极采用Pb-Sb合金板栅可以减少蓄电池在寿命循环中活性物质的脱落。
在H2SO4溶液中,氧很容易在负极上被还原:
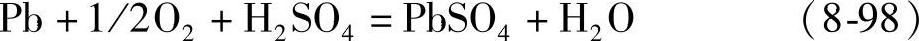
这也是导致蓄电池在开路搁置时自放电的原因。这一反应也被用来消除过充电产生的氧气,是阴极吸收密封蓄电池的理论基础。
一些杂质的存在,会大大加速自放电。如Fe2+离子就像催化剂一样加速正极和负极活性物质的自放电:
在正极PbO2+3H++HSO4-+2Fe2+=PbSO4+2H2O+2Fe3+
(8-99)
在负极Pb+HSO4-+2Fe3+=PbSO4+H++2Fe2+(8-100)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




