20世纪40年代出现的干式荷电蓄电池【19】,作为起动用蓄电池的主导产品曾占据市场几十年之久。
蓄电池的干荷电性能主要决定于负极活性物质中PbO含量。PbO含量越低,干荷电性能越好。蓄电池首次注液后,由于极板(主要是负极板)中的PbO与H2SO4发生中和反应,引起蓄电池的电动势降低(相对于不含PbO的情况),电解液浓度降低,反应焓变引起蓄电池的温度升高。干式荷电蓄电池的这几种效应,较之干式非荷电蓄电池(dry discharged battery)要小得多。虽然有人认为用电解液密度和电动势降低程度来判断蓄电池的干荷电性能,特别是在低温(如0℃)的情况下,不够精确而提出了另外的判断方法【21】,但是,电解液密度和电动势的变化与蓄电池温度的变化毕竟是蓄电池首次注液后最基本最直观的变化。根据这些变化判断蓄电池的干荷电性能具有半定量价值,由此得出的结论可以作为对极板半成品品质要求的重要依据之一。这些变化除了依赖于注液后参加化学反应的物质的量与热力学数据外,还与产品设计的诸因素有关。现在就产量较大的塑料槽蓄电池作些分析。引用蓄电池的电动势的公式(7-63),即
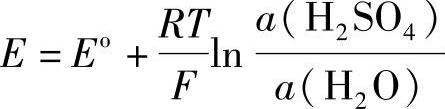
为了找出有关的a(H2SO4)和a(H2O)数据,把表7-5的数据画成图8-10。
为计算由于负极板活性物质中PbO与H2SO4的中和作用引起的电动势降低,这里提出简化模型和有普遍性的数据如下。
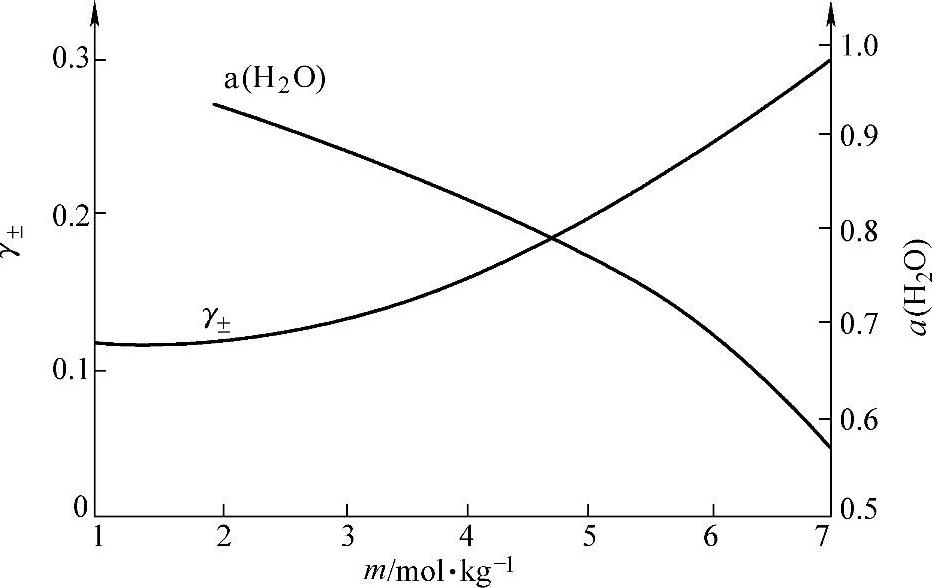
图8-10 H2 O-H2SO4体系中H2SO4的平均活度系数γ±和H2 O的活度a(H2 O)对于H2SO4的质量摩尔浓度m的依赖关系
(1)只考虑负极板中PbO与H2SO4的作用,反应消耗的H2SO4的量是按下式化学计量的:
H2SO4+PbO=PbSO4+H2O (8-77)并认为在注液后不太长的时间里反应达到平衡;
(2)负极板每安时额定容量的活性物质总量为0.0340mol,其中的PbO含量以摩尔百分含量计;
(3)首次注入的H2SO4溶液浓度为38.00%,即m=6.24mol·kg-1,每安时额定容量注液量为12.80g。
据此计算出来的1A·h铅酸蓄电池在首次注液达到平衡时的电解液浓度及活度,电动势的值见表8-20。
从表中可以看到,在起动用铅酸蓄电池使用的电解液的浓度范围,PbO含量每增加5%,电解液浓度下降约1%(即质量摩尔浓度m下降约0.24),电动势下降约8mV。干荷电性能良好的额定电压为12V的蓄电池,首次注液达到平衡后在25℃时的电动势不应低于12.70V。如果电动势不足12.70V,最好进行补充电,然后再使用。特别是首次注液后电解液温度通常会升高,而在这个浓度范围内,电动势的温度系数大于零,其值约为0.2~0.3mV·K-1,使得测得的电动势(或开路电压)的值较25℃时值稍大些。
表8-20 1A·h铅酸蓄电池首次注液后电解液的浓度与活度、电动势E对于负极活性物质中PbO含量的依赖关系(25℃)【22】
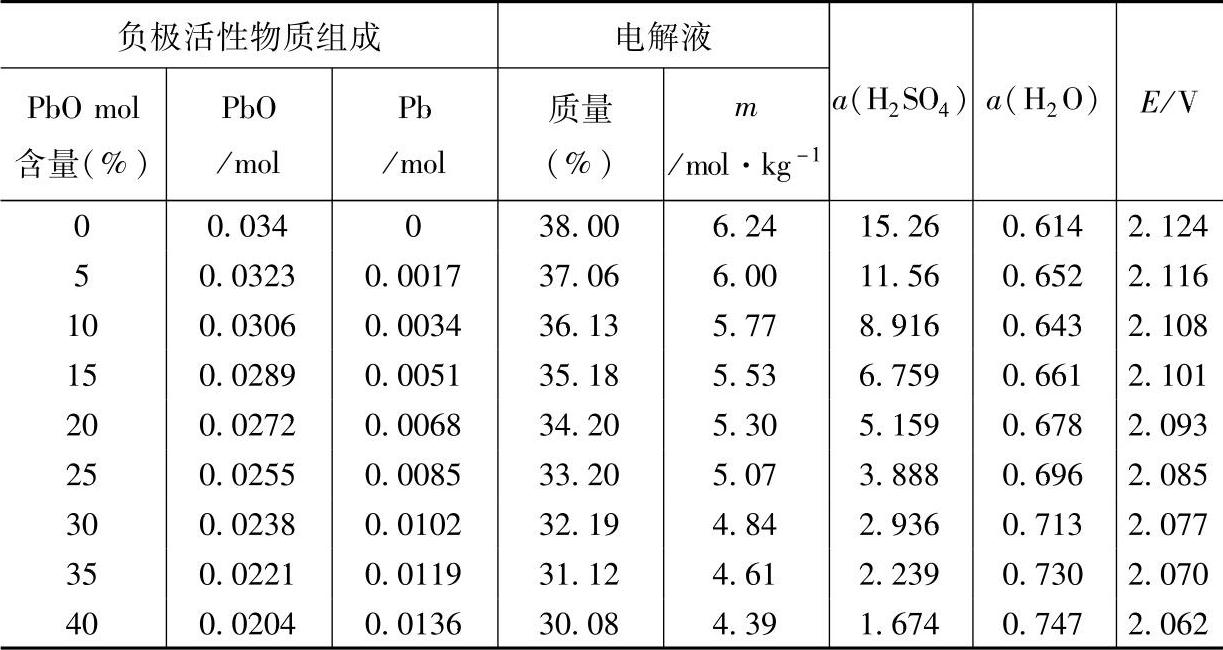
有理由认为,电动势的降低会导致蓄电池的放电时间(或容量)减少。图8-11是两只6-QA-60蓄电池的放电曲线。两只蓄电池的电动势、工作电压和放电过程中的极化过电位(包括电化学极化、浓差极化和欧姆电位降)分别用E1、E2、U1、U2和Δφ1、Δφ2表示,那么就有
E1=U1+Δφ1 (8-78)
和 E2=U2+Δφ2 (8-79)两式相减得到
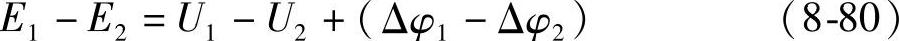
令ΔE=E2-E1和ΔU=U2-U1,式(8-80)可以写成
ΔU=ΔE+(Δφ1-Δφ2)(8-81)
事实上,对于同一厂家生产的同一种产品来说,干荷电性能好的蓄电池的过电位较小,即若E1>E2,则Δφ2>Δφ1。两只蓄电池在放电即将结束时的工作电压之差在图8-11中为
ΔU=U(B)-U(A)假定E1>E2,两只蓄电池的放电时间分别是tA和tB,U(B)就是放电要求的终止电压,那么
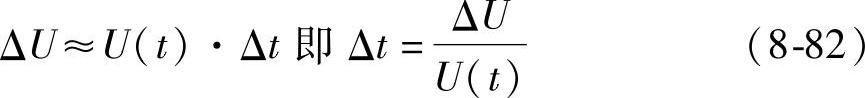
用(tA-tB)表示Δt,并把式(8-81)代入式(8-82)后者可以写成
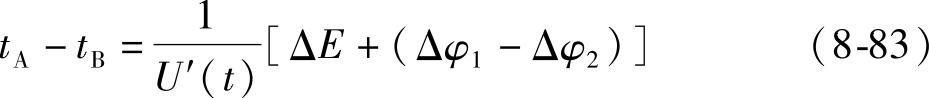
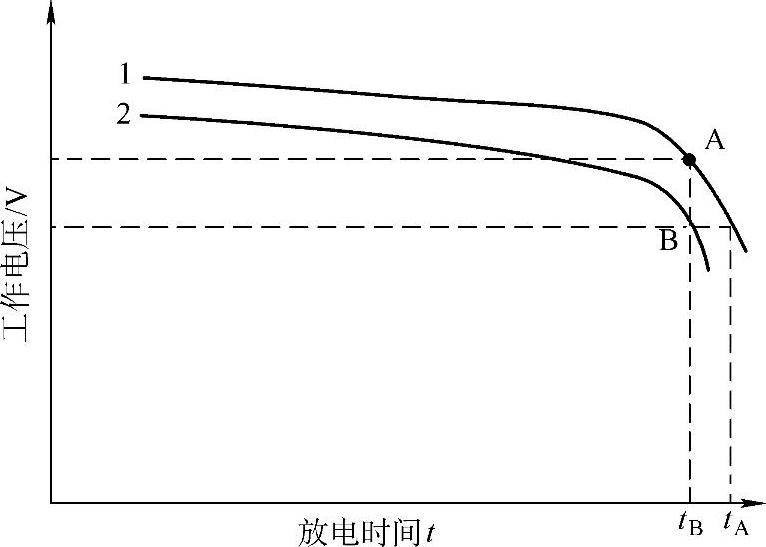
图8-11 6-QA-60蓄电池首次起动放电曲线示意图
如前所述,因为ΔE<0,所以Δφ1-Δφ2<0;在恒流放电时,工作电压U随着放电时间t是单调下降的,所以U′(t)<0,因此,式(8-83)右方是正值,所以可以得出结论
tA-tB>0,即tA>tB也就是说,同一类型的产品,放电条件相同,电动势高的放电时间长。由式(8-83)还可以看出,ΔE的绝对值越大,(tA-tB)的值也越大。即电动势下降越大,放电时间越短。
在工厂实验室不少厂家都不去测量蓄电池电动势(有时近似地用开路电压代替),而首次注液后的温度和电解液密度的测量,则应当是必做的。
如果我们只考虑负极板中PbO与H2SO4中和热,那么,放出的热量就是PbO含量的函数。中和反应的焓变可以从反应物和生成物的热力学数据求出,引用式(4-61)得出焓变,即
H2SO4+PbO=PbSO4+H2O(https://www.xing528.com)
ΔHo-814.1-219.1-920.0-286.0kJ反应焓变
ΔHoN=(-920.0)+(-286.0)-(-814.1)-(-219.1)
=-172.8kJ HoN是纯物质在标准状况下的反应过程的焓变。PbO与H2O- H2SO4体系中,H2SO4的中和反应焓变ΔHN还应包括另外两个因素:体系中水的微分稀释热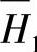 和H2SO4的微分熔解热
和H2SO4的微分熔解热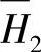 (参看第四章第九节)
(参看第四章第九节)

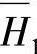 和
和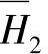 在不同浓度的值见表8-21【23】。可以根据表8-21中的数据用内插法或绘图的方法求出另外的浓度的
在不同浓度的值见表8-21【23】。可以根据表8-21中的数据用内插法或绘图的方法求出另外的浓度的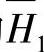 和
和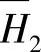 的值。用式(4-60)计算出来的ΔHN值见表8-22。
的值。用式(4-60)计算出来的ΔHN值见表8-22。
表8-21 H2O—H2SO4体系中水的微分稀释热H1和H2SO4的微分溶解热

(续)
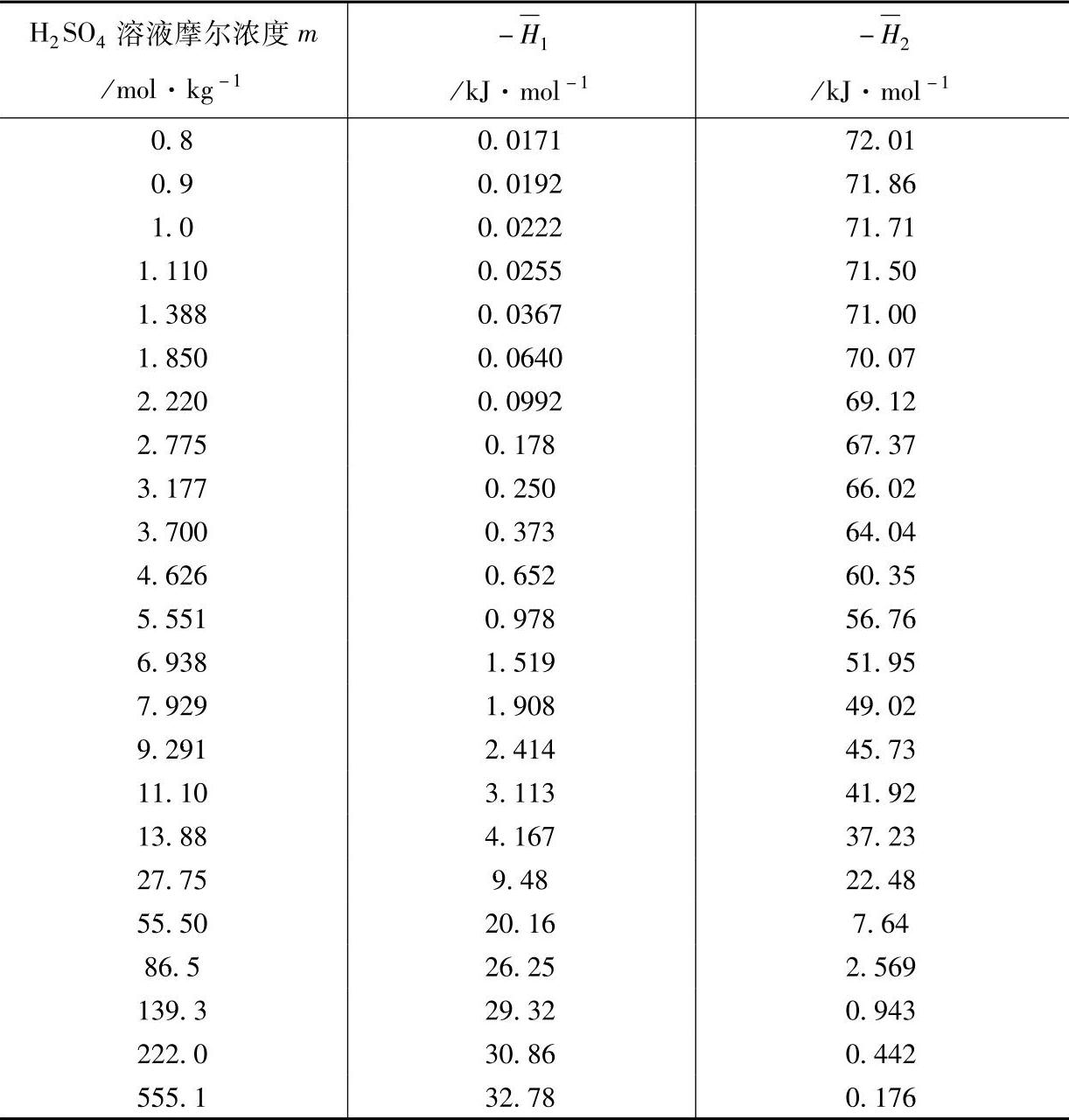
表8-22 H2SO4溶液与PbO的中和反应的焓变(25℃,101325Pa)
如果首次注入38.00%(m=6.24mol·kg-1)的H2SO4溶液,中和反应的焓变应为-119.8kJ·mol-1。60A·h的蓄电池,假定其负极板的活性物质为2.040mol,首次注液量为768.0g(1个单体蓄电池),那么,中和反应的焓变以及反应后的电解液浓度,无疑将依赖于PbO含量(见表8-23)。蓄电池的温升除了和反应的焓变有关外,和组成蓄电池的物质的热容以及环境散热情况也有关系。有关物质的恒压摩尔热容见本书第二章~第四章:
Pb(20℃时)26.5J·mol-1·K-1
PbSO4103.2J·mol-1·K-1
β—PbO262.26J·mol-1·K-1
PbO 45.80J·mol-1·K-1
硬质橡胶≈2.1kJ·mol-1·K-1
不同浓度的H2SO4溶液的热容见表8-23。
表8-23 60A·h单体蓄电池首次注液后中和反应焓变、电解液的热容对于PbO含量的依赖关系
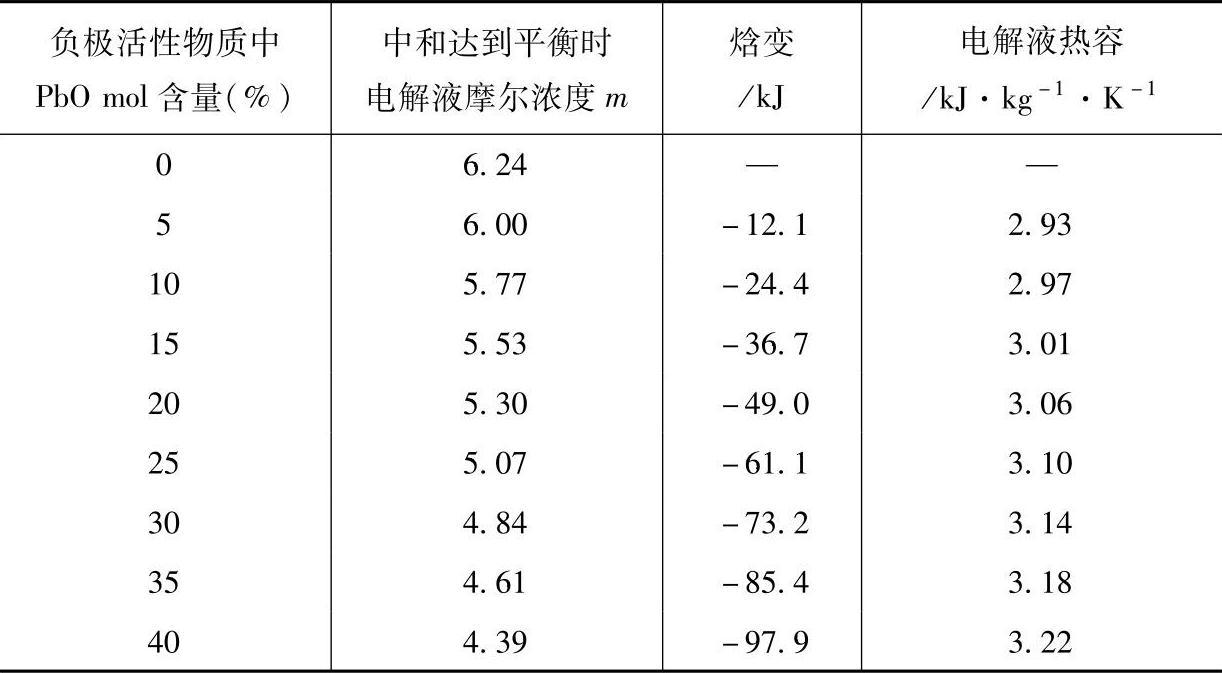
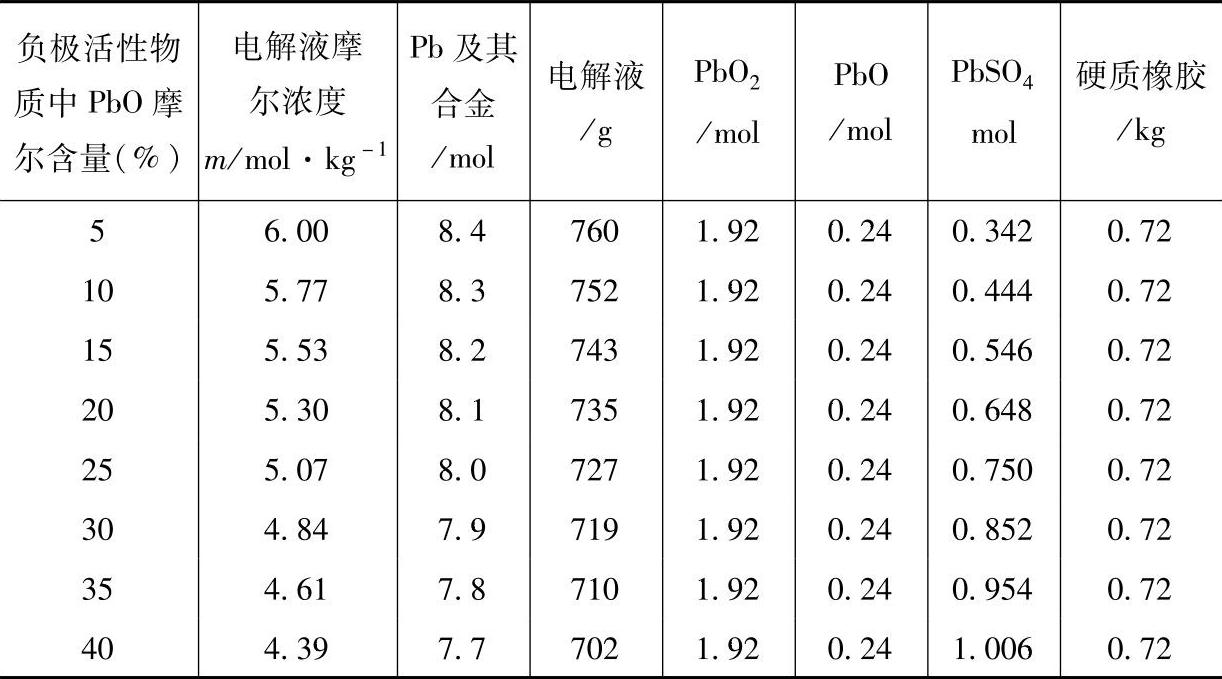
硬质橡胶蓄电池槽6-QA-60蓄电池在首次注液后中和反应达到平衡时,单体蓄电池包含的各种物质的量见表8-24。假定正极活性物质总量为2.40mol,与电解液不发生反应,其组成为
PbO2 1.92mol
PbO 0.24mol
PbSO4 0.24mol
不难看出,各种物质中热容最大的是电解液,全部电解液的热容值为其质量与热容之乘积,约为2.240±0.021kJ·K-1,其次为硬质橡胶(包括橡胶隔板),其热容值约为1.506kJ·K-1;铅及其合金、铅的化合物的总的热容值约为0.406~0.460kJ·K-1。虽然电解液的热容值随着浓度的降低而升高,但是电解液的量的变化则相反,所以电解液的热容大体上仍然是常数。不同浓度下各种物质的热容之和近似等于一个常数C,C≈4.18kJ·K-1。这就很容易估算蓄电池的温度升高——假定中和反应过程中蓄电池不和环境交换热量。
表8-24 60A·h单体蓄电池首次注液后反应达到平衡时包含各种物质的量
温升可以写成ΔT=Q/C,这里Q是中和反应热(见表8-22)。C是蓄电池的热容。计算结果表明,PbO的摩尔百分含量每增加1,温升增加约0.6℃。温升ΔT与PbO摩尔百分含量x有线性关系:
ΔT=0.6x (8-84)
这一关系如图8-12所示。
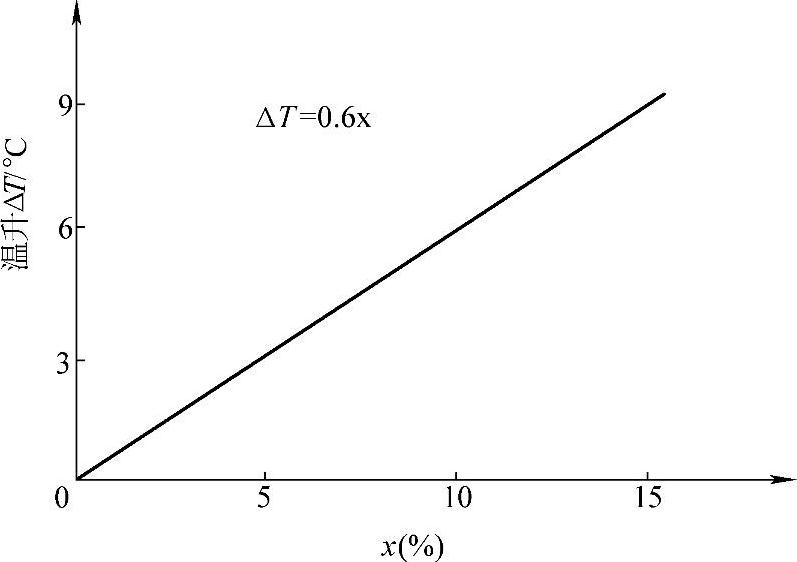
图8-12 起动用6-QA-60蓄电池首次注液的 温升ΔT和PbO摩尔百分含量x的关系
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




