铅酸蓄电池在放电时,特别是在大电流放电时,其端电压值较电动势降低很多,较按照全电路欧姆定律的计算值低很多。这里有一个实际例子,一只60A·h的蓄电池,经测定其内阻r=0.0015Ω,在放电电流I=180A恒流放电时,其端电压值如下:

这只蓄电池放电前的电动势E的测定值为2.11V。按照全电路欧姆定律V=E-Ir计算出来的端电压的值V=1.84V,而实际上是达不到的。
如果在蓄电池的放电过程中测定两极的电极电位,就可以得到如图7-9所示的情况。正极的电极电位φ+低于平衡电极电位φe+、而负极的电极电位φ-却高于负极的平衡电极电位φe-。
充电时的情况就不同了。充电时的正极电极电位φ+高于正极平衡电极电位φe+,而负极的电极电位低于负极平衡电极电位φe-。蓄电池充放电时的端电压V的表达式应是
充电时 V=φ+-φ-+Ir (7-133)
放电时 V=φ+-φ--Ir (7-134)
蓄电池充放电时两极电极电位的变化如图7-9所示。
当电流通过时,电极电位偏离于其平衡电极电位的现象叫极化(polarization)。某一电流密度下的电极电位φ与其平衡电极电位φe之间的差值Δφ=φ-φe称为(极化)过电位(overpo-tential)。
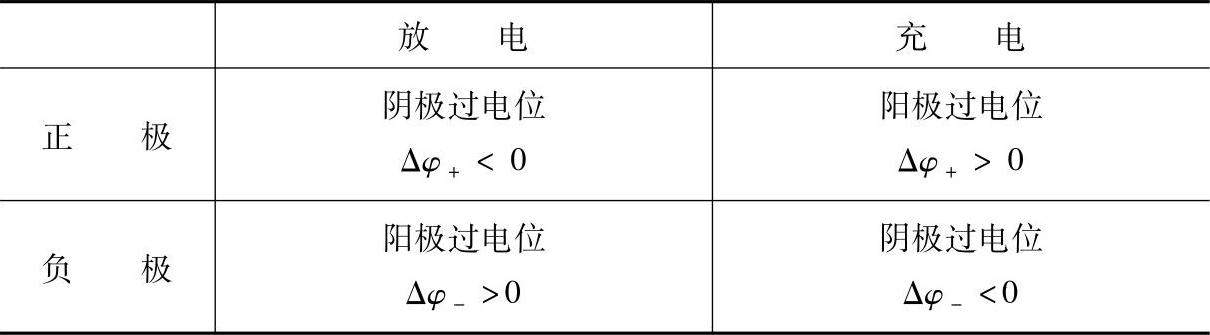
蓄电池充放电时极化过电位的名称与符号见表7-12。
极化过程和过电位是怎样产生的?我们知道,电极电位的值决定于电极表面电荷是正电或负电和密度。如果电极表面电荷的密度(甚至正或负)相对与平衡状态时发生了变化,电极电位必然偏离于平衡电极电位。
一个最简单的例子是电解水时在负极析出氢气的电化学反应。氢的析出包括下面的过程:
(1)传质(mass transfer)过程 这一过程包括H+离子由于电极表面与溶液内部浓度的差别向电极表面扩散(diffusion)以及H+离子在电场作用下向电极表面迁移(migration);(https://www.xing528.com)
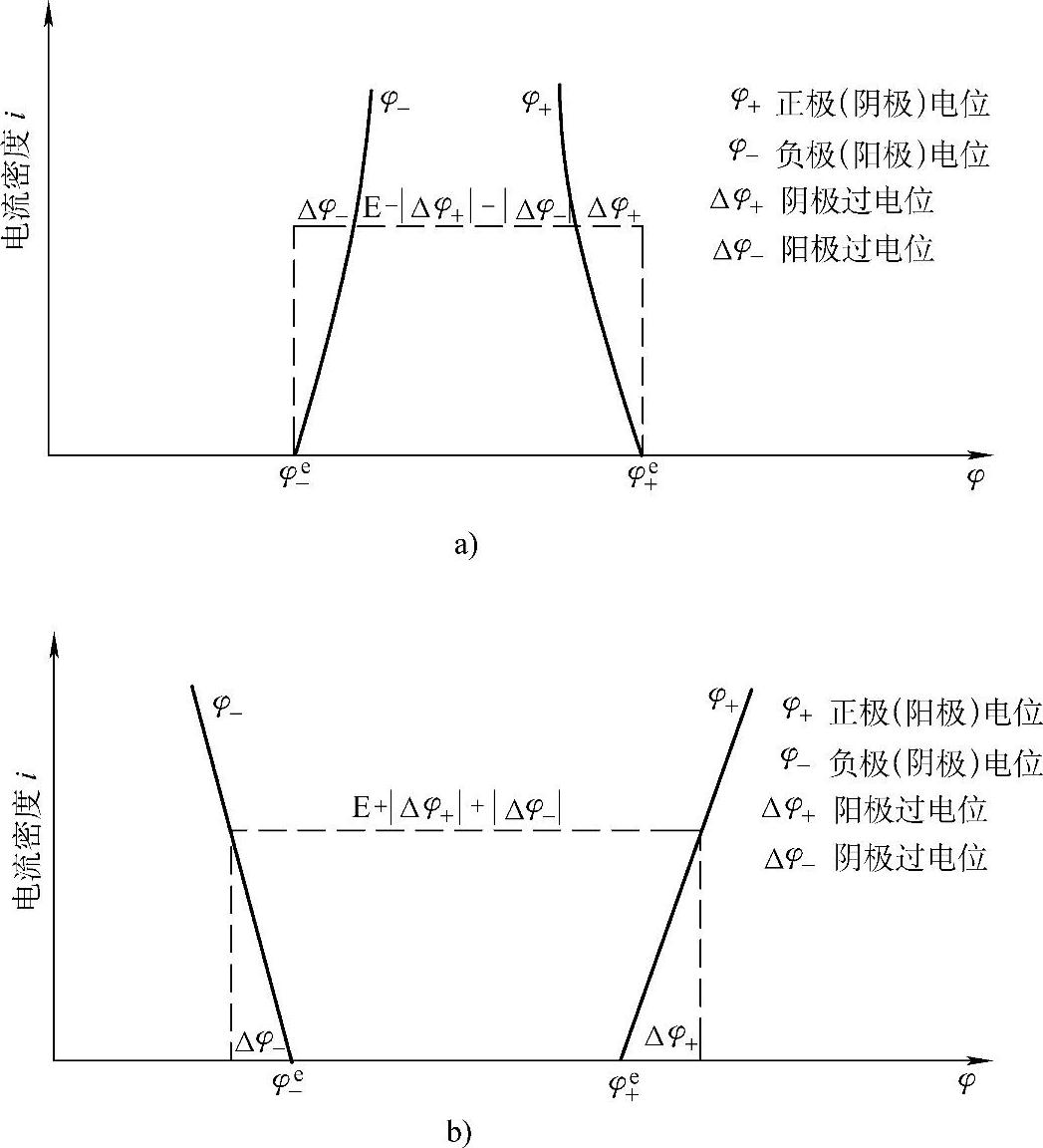
图7-9 铅酸蓄电池充放电时电极电位偏离于平衡电极电位的情况
a)放电 b)充电
表7-12 蓄电池充放电时极化过电位的名称与符号
(2)电荷传递(charge transfer)过程 这一过程包括三个步骤:
1)H+离子在电极表面得到电子生成氢原子
H++e=H (7-135)
2)两个氢原子结合成氢分子
H+H=H2 (7-136)假定电流强度为1A。这意味着每秒钟向电极上要输送6.3×1018个电子。如果这时H+离子向电极的传质(扩散和迁移)没有这么快,便会导致电子在电极上堆积,使得电极电位降低(变负)。由于离子的传质导致电极与溶液界面的离子浓度不同于溶液内部而产生的极化现象叫做浓差极化(concentration polarza-tion),由此引起的过电位叫做浓差过电位(concentration overpo-tential)。
3)如果这时的H+离子有足够的传质速度,而电化学反应H++e=H和H+H=H2相对较慢引起极化,这种极化叫做电化学极化(electrochemical polarization),由此引起的过电位叫做电化学过电位(electrochemical overpotential)。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




