一种元素的平衡电极电位,不仅与温度、压强有关,而且依赖于溶液的pH值。表示这种依赖关系的电化学平衡图叫做电位-pH图,即φ-pH图。
氢电极和氧电极对研究蓄电池的充电副反应、自放电和维护性能等都是至关重要的。我们先看看这两个电极的φ-pH图。为书写简单,把能斯特方程中RT/F后面写成常用对数,并讨论T=298·15K(25℃)的情况。氢电极的电极反应是
2H++2e=H2(气相) (7-102)
平衡电极电位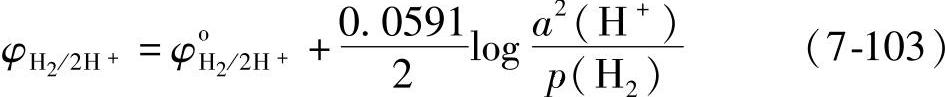 当氢气压强pH2=101325Pa(1atm)时
当氢气压强pH2=101325Pa(1atm)时
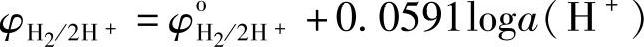
采用氢标,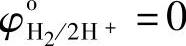 ,则
,则
φH2/2H+=0.0591pH (7-104)
在以φ为纵坐标,pH为横坐标的图上,这是一条在纵轴上截距为零、斜率为-0.0591的直线。
氧电极的电极反应是
O2+4H++4e=2H2O(液相) (7-105)平衡电极电位
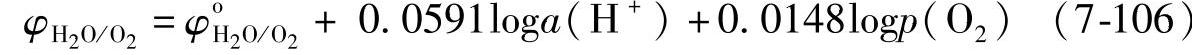
当氧气压强p(O2)=101325Pa(1atm)时,
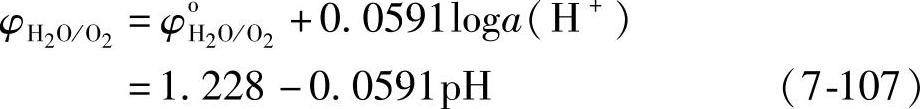
氢电极和氧电极的φ-pH图画在图7-6上。由图可以看出,在蓄电池充电时,如果正极的电极电位高于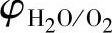 ,即在
,即在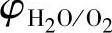 以上,则可能析出氧气;如果负极的电极电位低于
以上,则可能析出氧气;如果负极的电极电位低于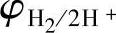 ,即在
,即在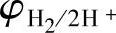 之下,则可能析出氢气。在两条线之间,是水的稳定区域。由于气体析出过电位的存在,实际上的
之下,则可能析出氢气。在两条线之间,是水的稳定区域。由于气体析出过电位的存在,实际上的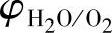 和
和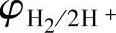 线分别高于和低于上述两条线。
线分别高于和低于上述两条线。
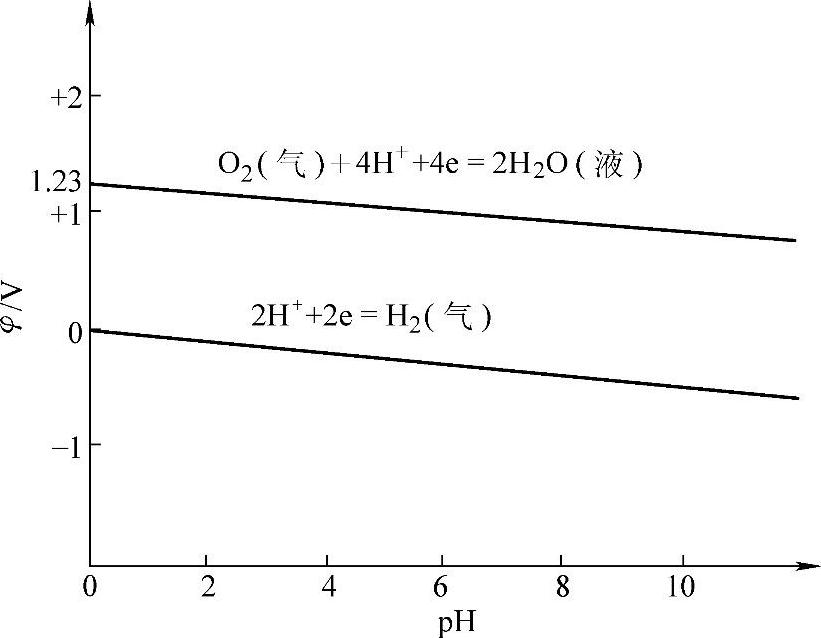
图7-6 氢电极和氧电极的φ-pH图
一般说,φ-pH图由于反应类型不同而分为三类:
(1)只有电子转移的过程,如
Pb2++2e=Pb (7-108)
平衡电极电位
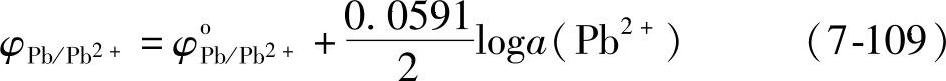
电极反应与pH无关,其图像是一条平行于pH轴的直线。
(2)只有质子转移的过程,如
Pb2++H2O=PbO+2H+ (7-110)这一反应的平衡常数为K

当a(Pb2+)为常数时,a(H+)也是常数,即pH为常数
pH=6.36-1/2loga(Pb2+) (7-112)反应过程中各离子的电荷均无变化。这种类型的反应和电极电位无关,其图象是一条平行于电位轴的直线。
(3)既有电子,也有质子转移的过程,如
PbO+2H++2e=Pb+H2O (7-113)
平衡电极电位
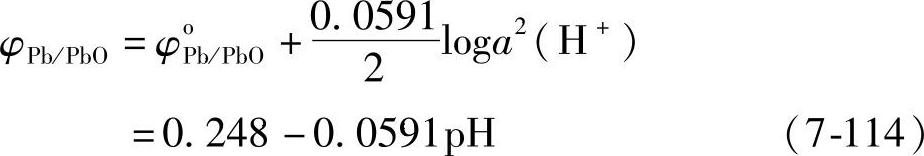
这是一条斜率为-0.0591、截距为0.248的直线。
现在,通过一个实际例子来讨论Pb-H2O体系的电极电位与pH的关系。在一个含有a(Pb2+)=10-2 M的溶液中,插一支Pb电极,在溶液中连续加入NaOH(溶液体积不变),已知
Pb(OH)2+OH-=Pb(OH)-3 (7-115)的稳定常数Ks=10-1.3。在pH≥13.3时,有电极反应
Pb(OH)3-+3H++2e=Pb+3H2O (7-116)求此铅电极的φ-pH图。
要得出这个问题的答案,应先了解在溶液中连续加入NaOH时,溶液中生成沉淀,生成络离子以及发生电极反应的情况。
第一步,根据溶度积法则判断当pH为何值时开始生成Pb(OH)2沉淀。已知Pb(OH)2的溶度积Ksp=10-15.3。
而a(Pb2+)=10-2,由a(Pb2+)·a2(OH-)=10-15.3,求出当a(OH-)=10-6.65即a(H+)=10-7.35(pH=7.35)时开始产生Pb(OH)2沉淀。
第二步,继续加入NaOH,pH进一步增大,由于生成络离子而使Pb(OH)2溶解。当Pb(OH)2完全溶解时有
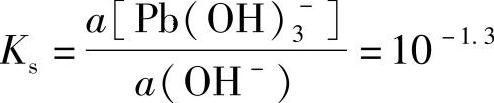
最初溶液中a(Pb2+)=10-2,此时a[Pb(OH)3-]也应是10-2,所以,当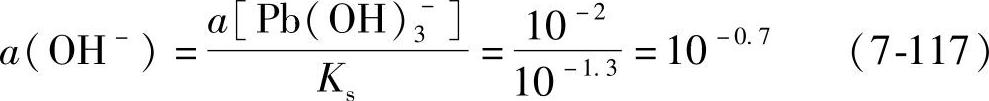 即当pH=13.3时,Pb(OH)2完全溶解。
即当pH=13.3时,Pb(OH)2完全溶解。
在13.3≥pH≥7.35时,液相中有两种形式的铅离子,它们的活度分别由Pb(OH)2的溶度积、Pb(OH)3-的稳定常数与a(H+)决定
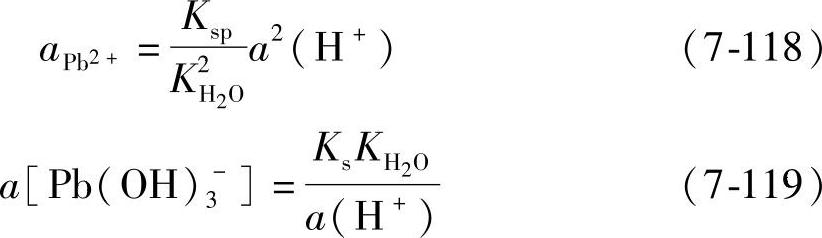 (https://www.xing528.com)
(https://www.xing528.com)
式中,KH2O是水的离子积,其值≈10-14。
现在把pH≤13.3的φ-pH图作出来。当pH≤7.35时,电极反应为
Pb2++2e=Pb (7-120)
平衡电极电位
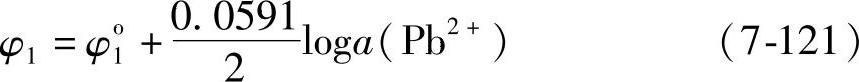
查表知φo1=-0.13V。a(Pb2+)=10-2M是已知的,求出
φ1=-0.19V(图7-7线φ1) (7-122)
在这个pH区间,电极反应只有电子转移,平衡电极电位和pH无关,是一条平行于pH轴的直线。
当13.3≥pH≥7.35时,可以仍然按照式(7-121)写出平衡电极电位。此时a(Pb2+)不再是常数,而是a(H+)的函数,由式(7-118)可知
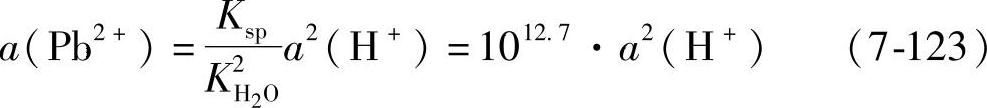
代入式(7-121)得到平衡电极电位
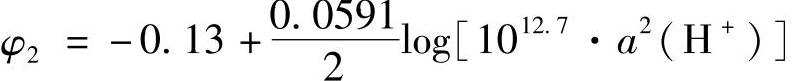
=0.25-0.0591pH(图7-7线φ2) (7-124)平衡电极电位与a2(H+)有关,说明在此区间的电极反应与下式相当:
Pb(OH)2+2H++2e=Pb+2H2O (7-125)
这一反应的标准电极电位φ2o=0.25V (7-126)
式(7-124)表示的是一条斜率为-0.0591、截距为0.25的直线。线段的两个端点分别是
pH=7.35,φ1=-0.19V(图7-7点A) (7-127)
pH=13.3,φ1=-0.55V(图7-7点B) (7-128)
当pH≥13.3时,液相中不存在Pb2+离子,而有下面的电极反应:
Pb(OH)3-+3H++2e=Pb+3H2O (7-129)平衡电极电位
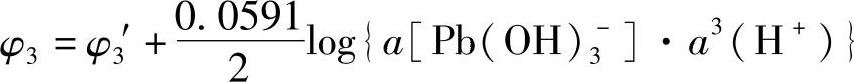
即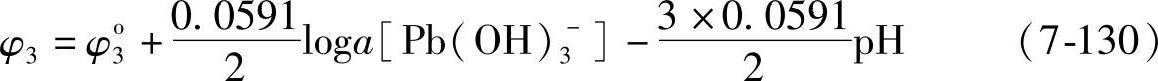
式中φ03应有确定的值。由于函数φ-pH是连续的,式(7-128)亦应适合式(7-130)。当a[Pb(OH)3-]=10-2M,pH=13.3时,φ3的值应为-0.55V,即
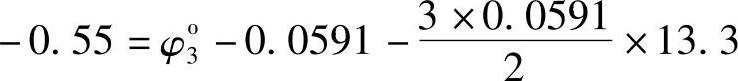
得到φ3o=0.69V (7-131)
将φ3o的值代入式(7-130)得到
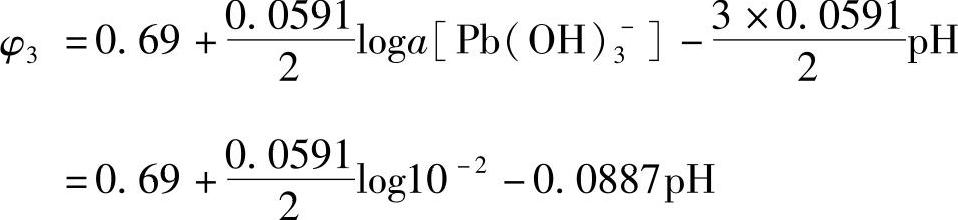
即 φ3=0.65-0.0887pH(图7-7线φ3) (7-132)
这是一条斜率为-0.0887、截距为0.65的直线,与pH轴交于7.30(图7-7点C)。以上关于这一问题的答案如图7-7所示。
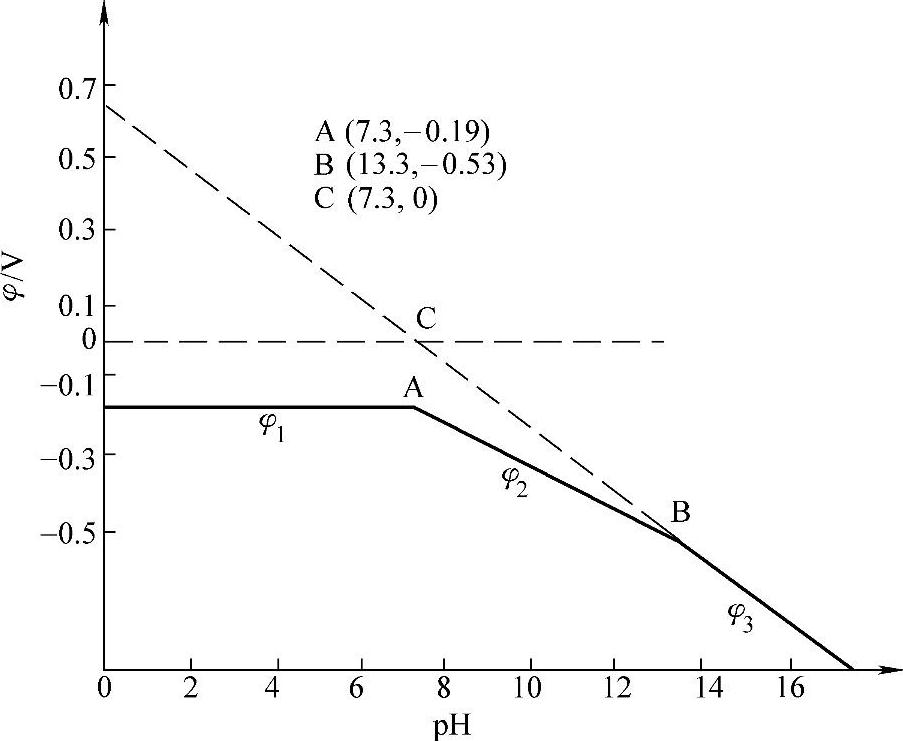
图7-7 Pb在a(Pb2+)=10-2M溶液中的φ-pH图
比利时学者鲍贝克斯(Pourbaix)在20世纪30年代开创的φ-pH图这一学术领域很快就被应用于电化学。他在著作中汇集了多种元素的φ-pH图【21】。
图7-8中线ⓐ与ⓑ之间是水的热力学稳定区域。图中圆圈中的字母和数字表示的反应和电极电位如下【22】:

①和②的氧化还原反应,只有电子转移,无H+参加,电位与pH无关,φ-pH图是平行于pH轴的直线。
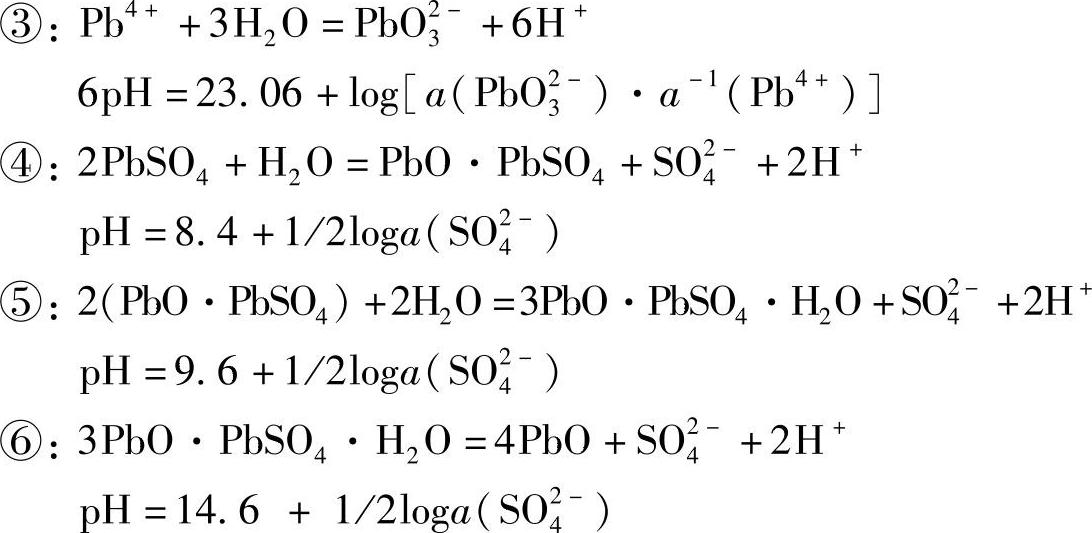
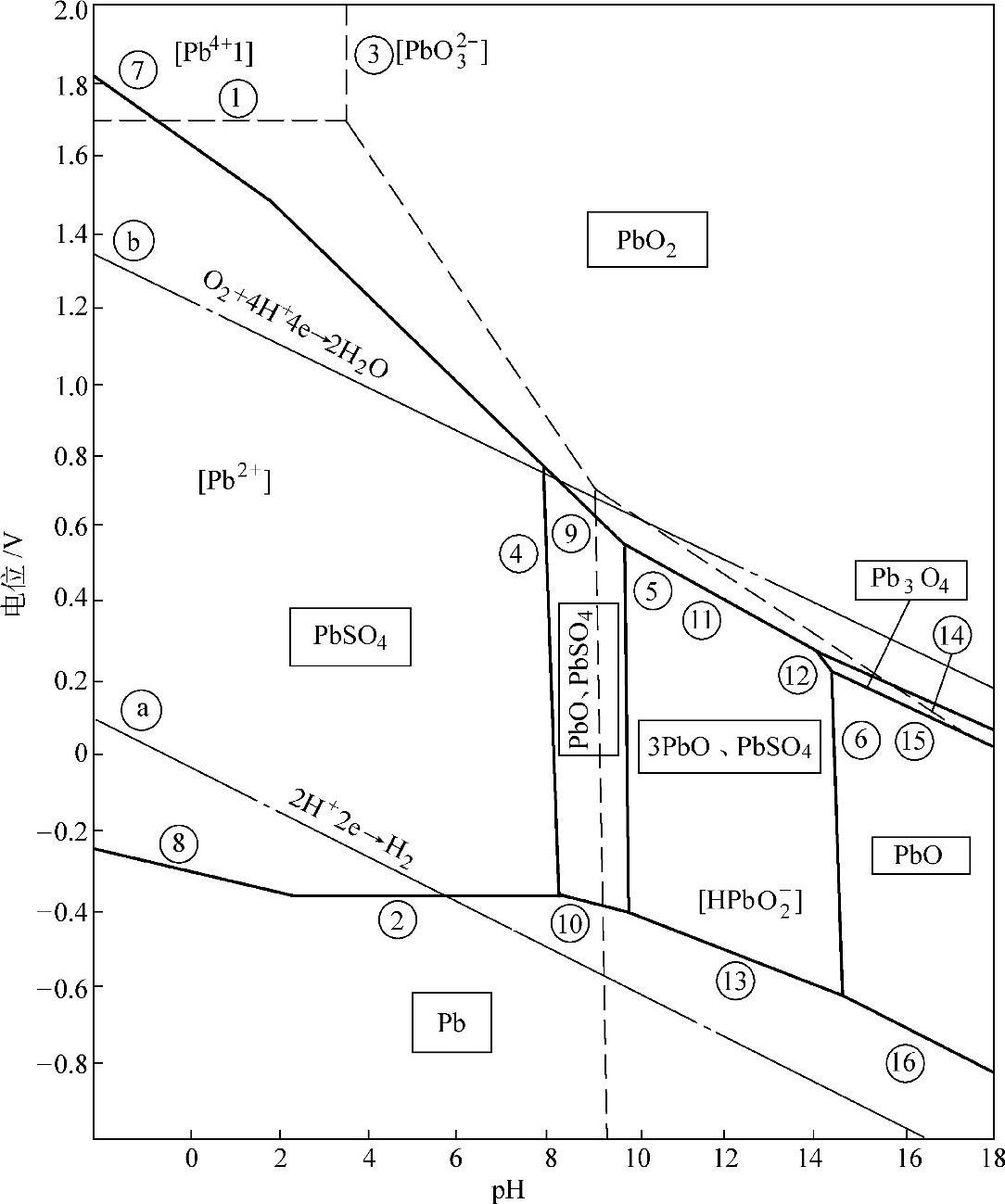
图7-8 Pb-H2O-H2SO4体系的φ-pH图
③~⑥不是氧化还原反应,无电子转移,只有质子转移,pH值是常数,与电极电位无关,φ-pH图是平行于φ轴的直线。
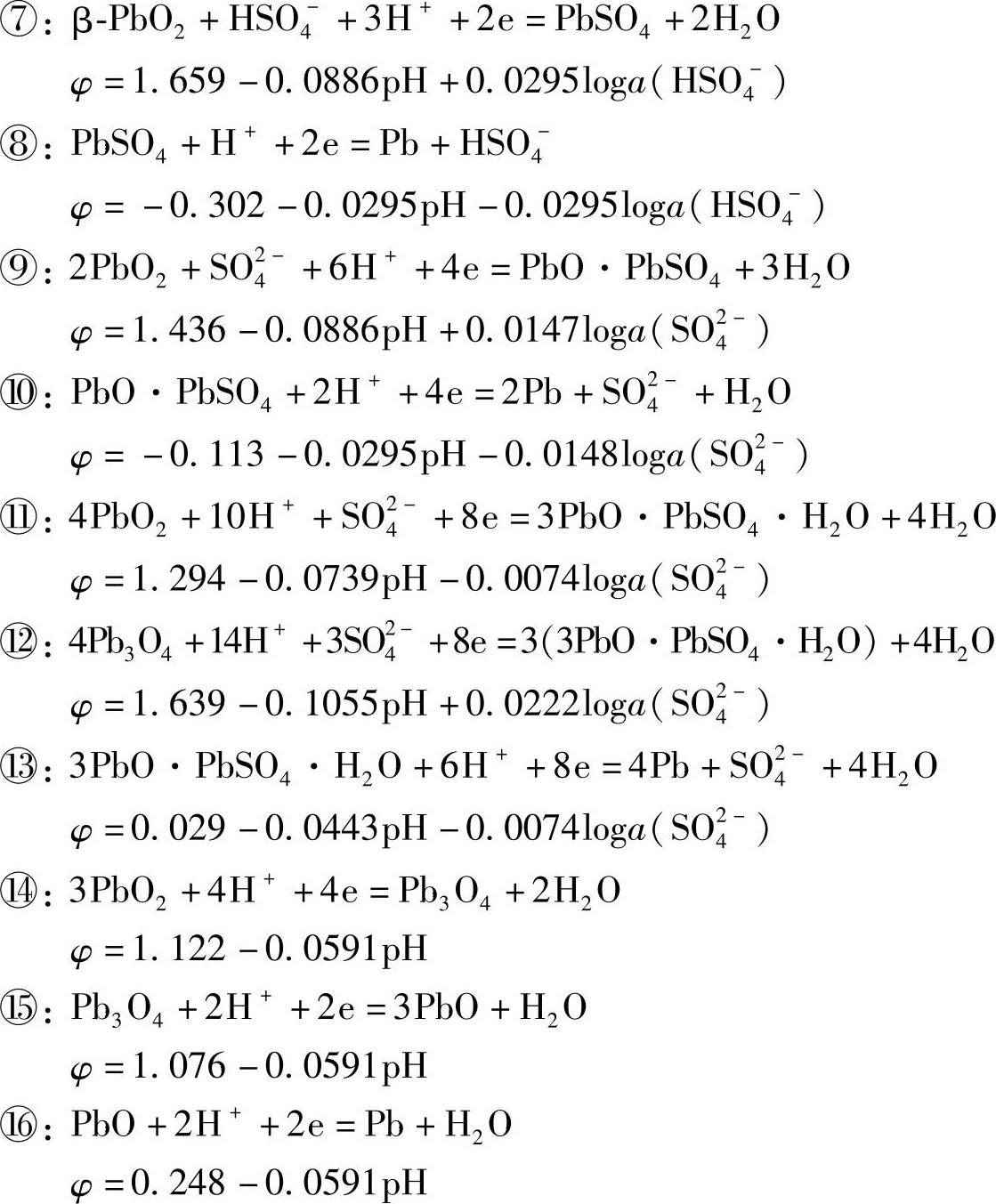
⑦~⑪⑪⑯是既有质子转移,又有电子转移的氧化还原反应,它们的φ-pH图是斜线。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




