蓄电池的电动势是正极(电位高的一极)与负极(电位低的一极)的平衡电极电位之差。若没有另一个电极做参比,一个电极的电极电位是无法知道也无法测量的。这正如一个地方的高度只有相对于另一个地方来说才是确定的一样。为了测定不同电极电位的相对数值,就必须选出统一的参考点,即参比电极(reference electrode),认为其平衡电极电位为零。习惯上选用标准氢电极(standard hydrogen electrode;normal hydrogen electrode NHE)作为参考点:
Pt(镀铂黑)H2(101325Pa),H+{a(H+)=1}规定在任何温度下,标准氢电极的相对平衡电位都为零(即所谓氢标)。并定义任何电极,例如锌电极
Zn Zn2+{a(Zn2+)=1}的相对平衡电位为下面的电池的电动势:
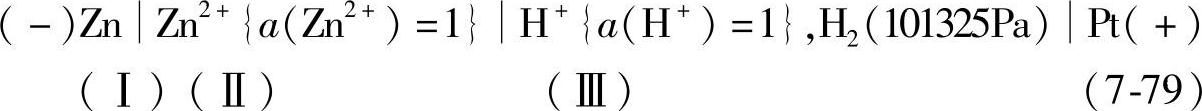
标准氢电极总是写在右方,因为它是参考点,规定电池的电动势E=φ左-φ右。
作了这一规定,则无论把锌电极电位表示成φZn/Zn2+或φZn2+/Zn,其值都是负的,一切还原性大于氢标准电极的电极的平衡电位,也都是负值;还原性小的,则都是正值。式(7-79)表示一种电池的写法,符号“”表示Ⅱ/Ⅲ相界的液体接界电位(junction potential)已经用“盐桥”(salt bridge)消除了。盐桥是用来减少液体接界电位的装置,常用高浓度的KCl溶液装入U形管中制成。由于K+与Cl-离子的扩散速率几乎相等,它与两种液体间因离子扩散速率差异而引起的液体接界电位很小且方向相反,因而抵消。
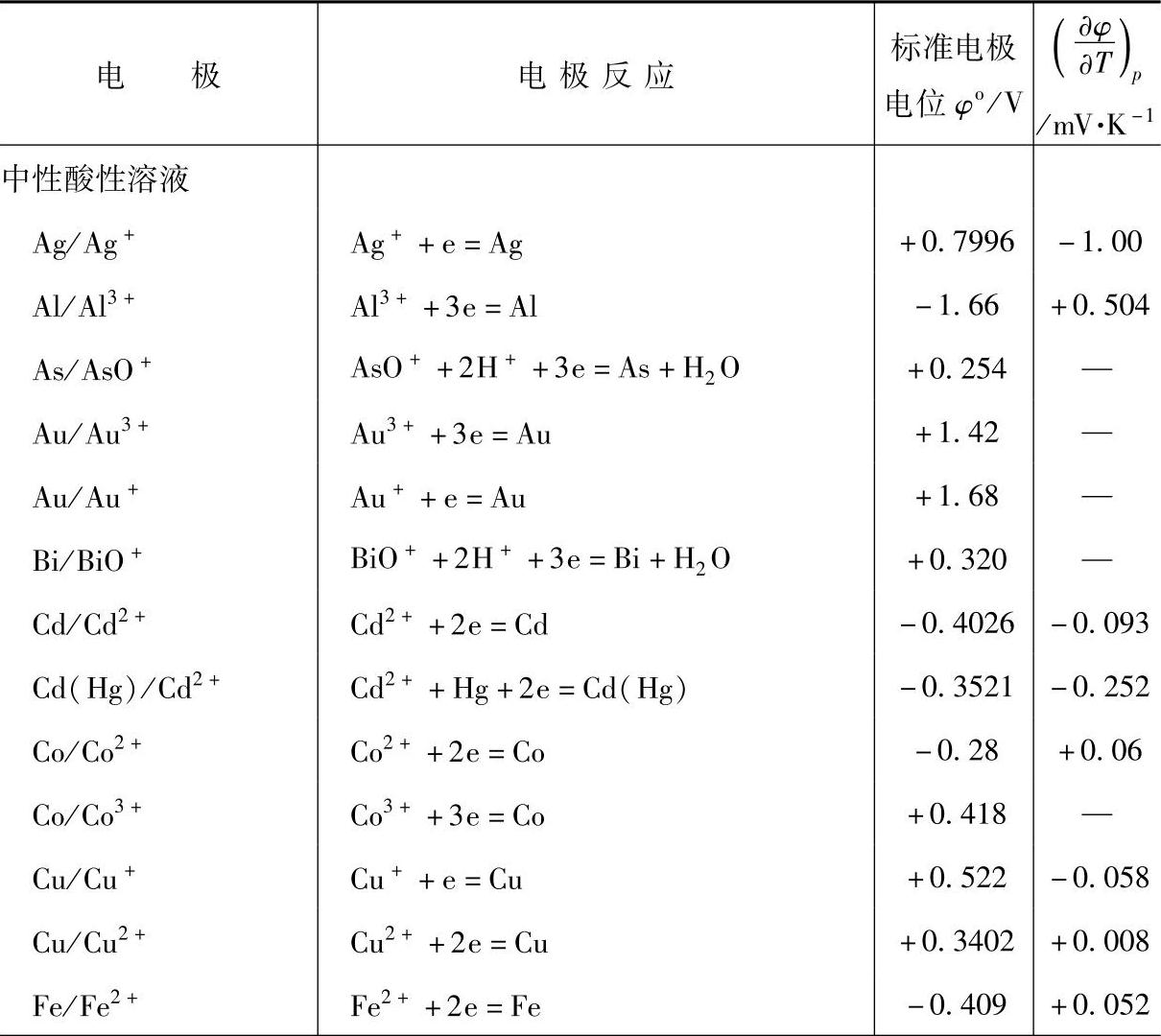
如果电极体系处于标准状况,即压强为101325Pa,温度为25℃,电极反应中物质的氧化态与还原态的活度都是1m(或1M),气体是101325Pa的纯气体,固态物质都处于稳定状态(活度为1单位),则该电极的氢标值就叫做标准电极电位φo。表7-10是一些电极的标准电极电位值。
表7-10 一些电极的标准电极电位(25℃,氢标)
(续)

(续)
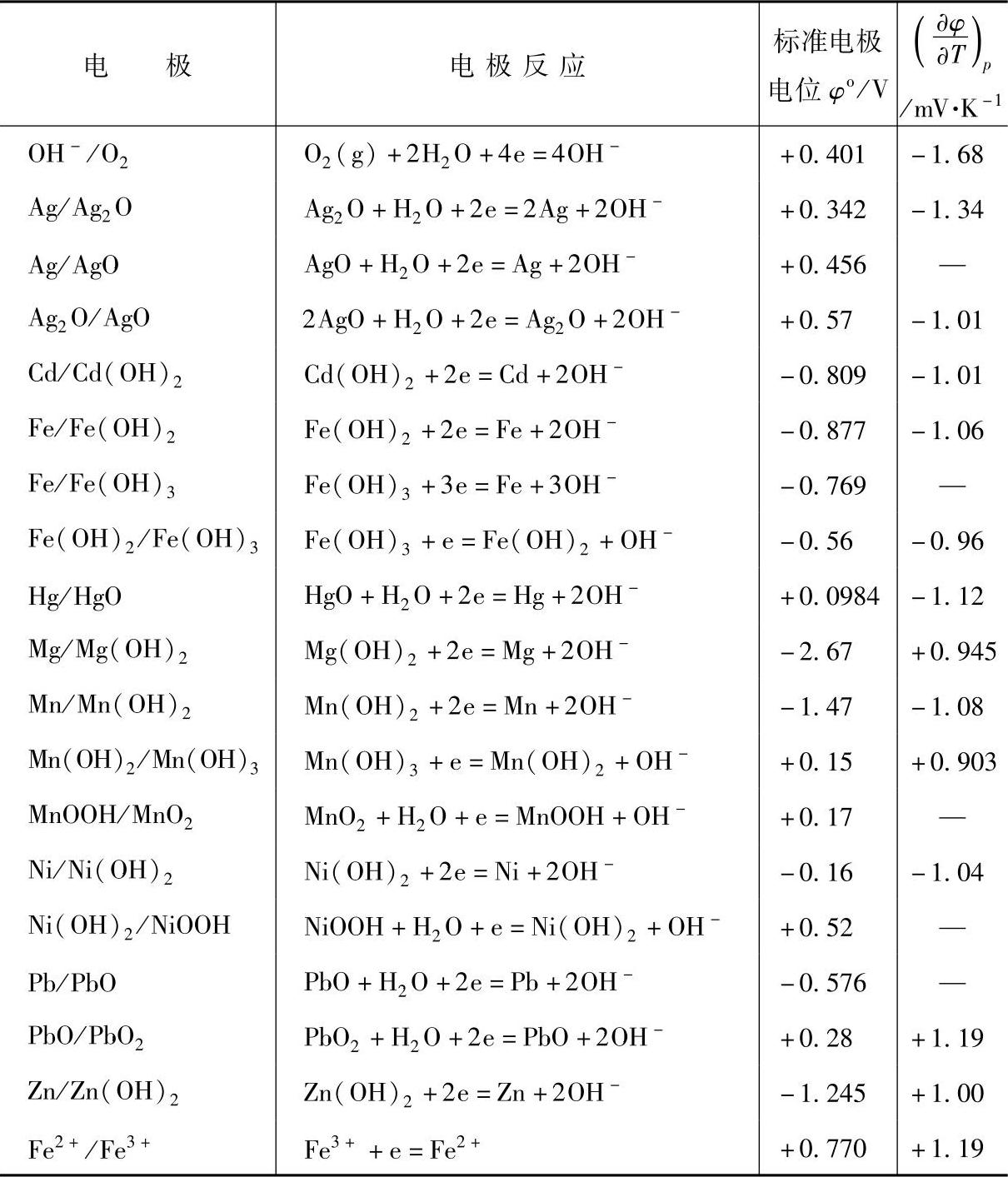
除NHE外,蓄电池生产厂家最常用的参比电极是镉电极Cd/Cd2+和硫酸亚汞电极Hg/Hg2SO4。
几种电极在H2SO4溶液中相互间的电极电位与H2SO4溶液浓度的关系表示在图7-5。
用Cd/Cd2+电极测量铅酸蓄电池的电极电位以其方便实用而被许多蓄电池生产厂家采用。早在1982年,卢卡斯(Lucas)就在AFA Varta采用了Cd/Cd2+电极。
在H2SO4溶液中,镉电极的电极反应是
Cd-2e=Cd2+ (7-80)
其电极电位为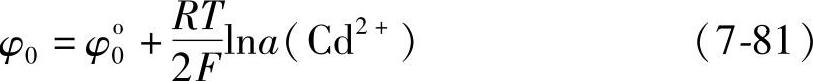
式中,φ0o=-0.402V。
由于金属Cd插入H2SO4溶液时,会发生析出氢的反应(虽然氢在Cd上高过电位在很大程度上抑制了氢的析出)
2H++2e=H2(7-82)
所以也可以说Cd/Cd2+电极电位实际上是上面两个电极反应的复合电极电位。
Cd/Cd2+电极与H2SO4溶液界面临域的离子活度a(Cd2+)很低,所以在用于蓄电池电极电位测量时,其电极电位较其标准电极电位更低(负)。一般情况下,它不仅比蓄电池的正极电位低得多,而且比负极的电位也低。
用Cd/Cd2+电极测量蓄电池正极电位时,蓄电池的正极(作为正极)和它(作为负极)组成电池,电极反应是【20】
正极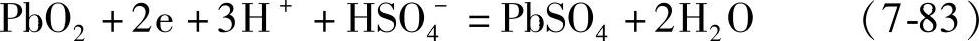
其电极电位是
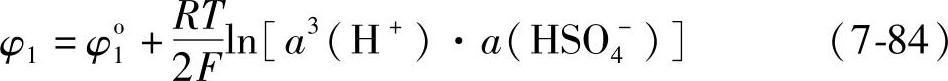
式中,a3(H+)、a(HSO4-)分别是H+、HSO4-离子的活度。25℃时,φo1=1.69V。
负极 Cd-2e=Cd2+ (7-80)
其电极电位决定于式(7-81)。电池反应是
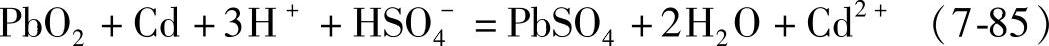
这个电池的电动势E1即式(7-84)与式(7-81)之差
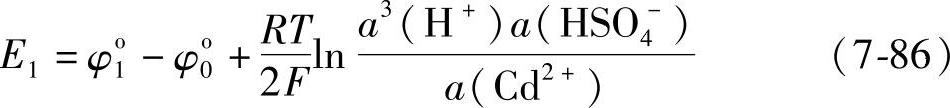
注意到a(H+)·a(HSO4-)=a(H2SO4),式(7-86)可以写成
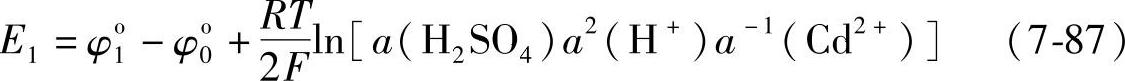
其标准电动势(25℃)为Eo1=φo1-φ0o=2.092V。
用Cd/Cd2+电极测量蓄电池负极电位时,一般情况下蓄电池的负极(作为正极)和它(作为负极)组成电池。电极反应是
正极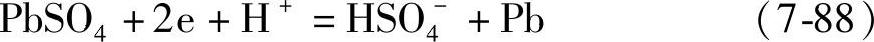 其电极电位
其电极电位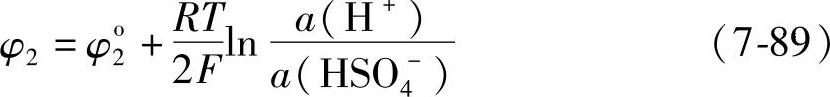 25℃时φ2o=-0.358V。负极反应同式(7-80),电极电位同式(7-81)。电池反应是
25℃时φ2o=-0.358V。负极反应同式(7-80),电极电位同式(7-81)。电池反应是

这个电池的电动势E2即式(7-89)与式(7-81)之差,即
 (https://www.xing528.com)
(https://www.xing528.com)
其标准电动势(25℃)为E2o=φ2o-φ0o=0.044V。
在蓄电池充电后期,有氢气较大量地析出,蓄电池负极的电极电位会降至比Cd/Cd2+电极电位还低。这时如果用Cd/Cd2+电极测量蓄电池负极的电位,组成电池的两个电极反应是
正极 Cd2++2e=Cd
负极 H2-2e=2H+
电池反应是 Cd2++H2=Cd+2H+ (7-92)这个电池的电动势E3是式(7-81)与H2/2H+电极的电位差,其标准电动势在25℃时为E03=-0.402V。
测量中,如果仍然以Cd/Cd2+电极为参比电极接电位计的负端,这时读数就会出现负值。如果调换正负端位置(即Cd/Cd2+电极接电位计正端),应在读数前加上负号表示此时蓄电池负极的电位低于Cd/Cd2+电极。
如果制造电极的材料镉的纯度高并且使用维护得当,Cd/Cd2+电极的电位的重复性可达10~20mV。这对于生产厂家,用户处理生产和使用中的一些问题,精度可以满足要求,但用于实验研究却是不够的。
铅酸蓄电池实验研究中测量电极电位最常用的是Hg/Hg2SO4(汞/硫酸亚汞)电极。这种电极的电极反应是
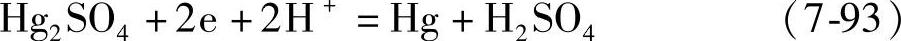
其电极电位
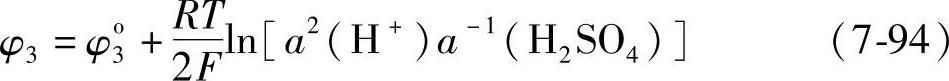
在25℃时,φ2o=0.616V。
H2/2H+电极的电极反应与电极电位φH2/2H+分别是
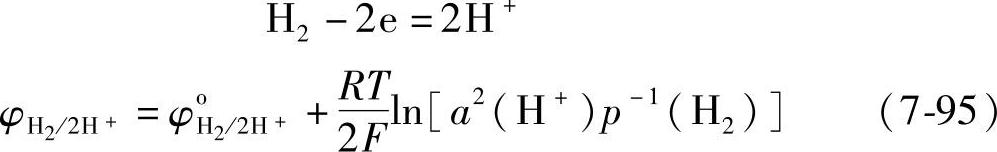
式中,p-1(H2)是氢气的压强。当p(H2)为单位压强时,式(7-95)变为
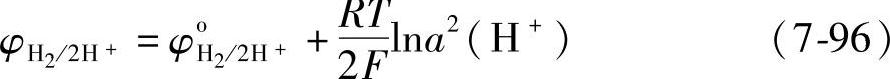
式(7-94)与式(7-96)之差就是Hg/HgSO4电极与氢电极组成的电池的电动势
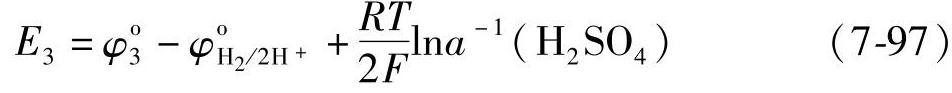
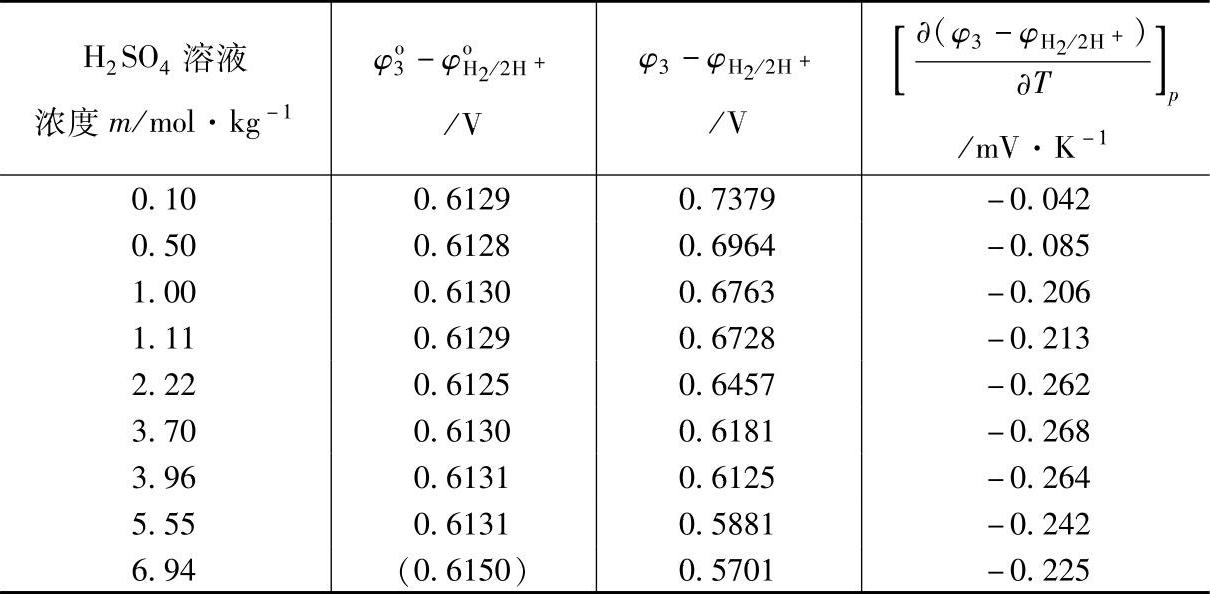
E3随着H2SO4的活度的增大而降低,随浓度变化的有关数据列在表7-11中。出处同表7-7。
用Hg/Hg2SO4电极测量蓄电池正极的电极电位,两个电极组成的电池的电极反应和电池反应分别是
正极反应同式(7-83)。
负极反应同式(7-93),但在形式上改写为
2Hg-2e+H2SO4=Hg2SO4+2H+
电池反应 PbO2+2Hg+2H2SO4=PbSO4+Hg2SO4+2H2O
(7-98)这个电池的电动势E4=φ1-φ3,即
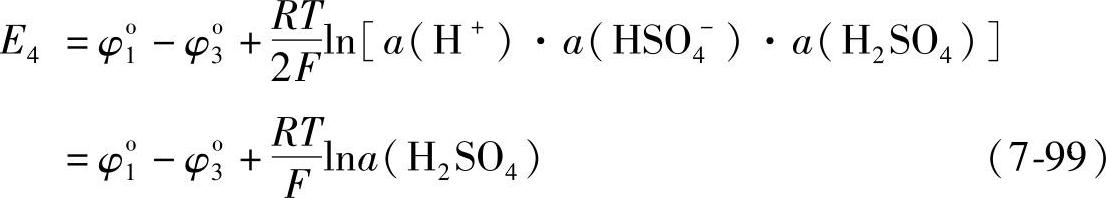
E4的值随着H2SO4活度的增大而升高,E4o=φo1-φ3o的值在25℃时为1.074V。
表7-11 Hg/Hg2SO4电极在H2SO4溶液中的电极电位(25℃)
用Hg/Hg2SO4电极测量蓄电池负极的电极电位,两个电极组成的电池的电极反应和电池反应分别是
正极反应同式(7-93);
负极反应同式(7-88),但改写为
Pb-2e+HSO4-=PbSO4+H+
电池反应Hg2SO4+Pb=2Hg+PbSO4(7-100)式(7-100)表明,反应物和生成物都是固相物质,它们的活度都是1,因而电池的电动势E5=φ3-φ2的值与H2SO4溶液的活度无关,应为常数,事实上,由式(7-94)φ3的表达式与式(7-89)φ2的表达式可以得出
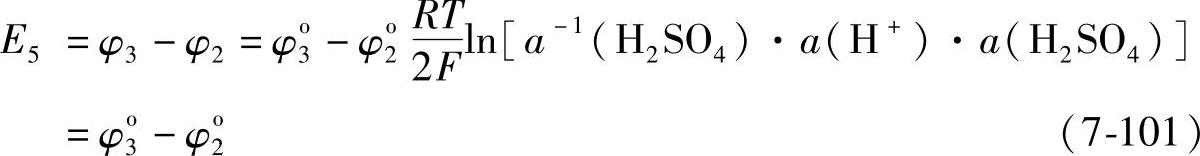
在25℃时,φ3o-φ2o=0.794V。
这一关系在图7-5中是一条平行于横轴的直线。图7-5是上述几种电极在H2SO4溶液中相互间的电极电位与H2SO4浓度的关系图。假定起动用铅酸蓄电池中电解液H2SO4的浓度m=5.55(即35.2%),在图7-5中A点标出这一浓度值。
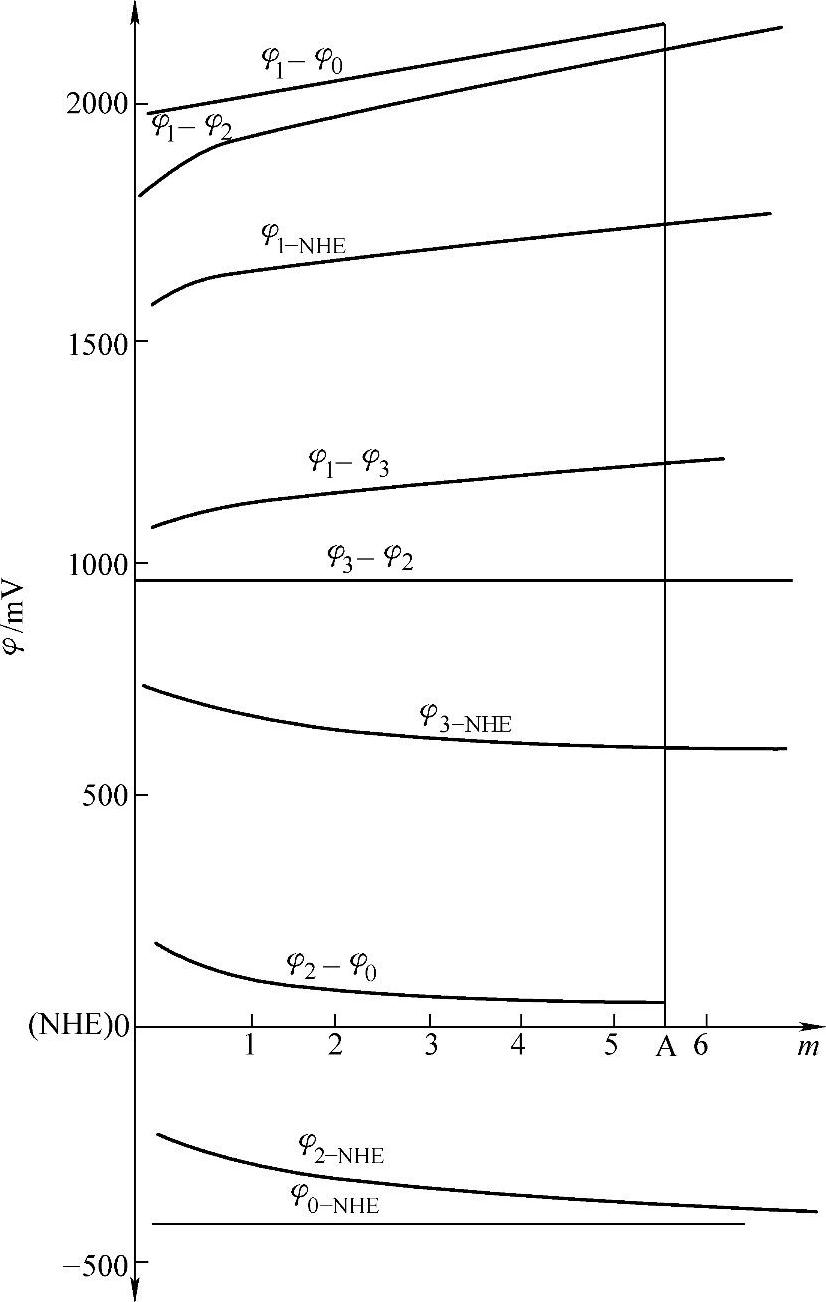
图7-5 几种电极在H2SO4溶液中相互间的电极电位与H2SO4溶液浓度的关系
φ0—Cd/Cd2+电极 φ1—PbSO4/PbO2电极 φ2—Pb/PbSO4电极 φ3—Hg/Hg2SO4电极
A(5.55,0)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




