热力学中的吉布斯-亥姆霍兹方程(Gibbs—Helmholtz equa-tion)公式告诉我们,在一定温度下,对一个化学反应有
ΔG=ΔH-TΔS(7-71)式中,H是焓;S是熵;G是吉布斯自由能;都是热力学函数。引入关系式

式中,脚标p表示恒压。式(7-71)可以写成
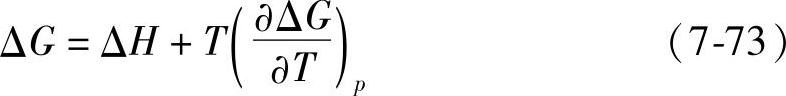
ΔG的意义是一个封闭系统(closed system)(与环境之间只有能量而无物质交换,但是这并不意味着此体系不能因有化学反应发生而改变其成分)所能做的最大非膨胀功。对于蓄电池来说,其自由能的减少就等于其电功,即
-ΔG=nFE (7-74)
式中,E是电动势;n是参加反应的物质的摩尔数,nF是反应电荷。代入式(7-73)得到
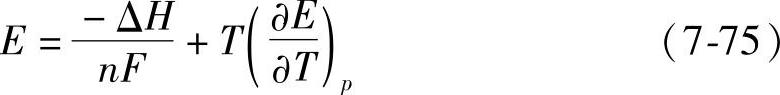
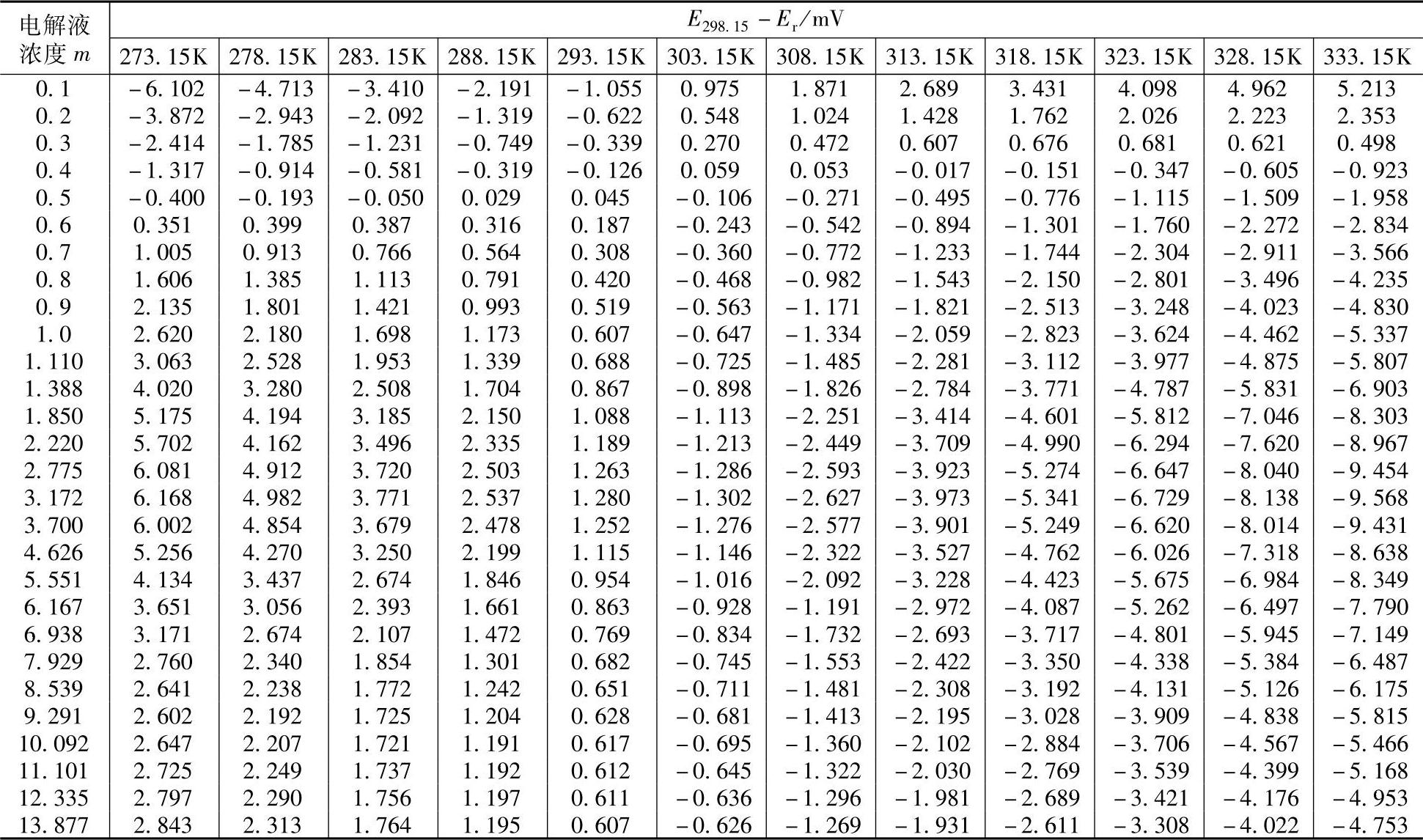
电动势E可以精确测量,可以从热数据得出ΔH的值,因而可以求出温度系数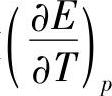 的值。下面列出两组有关数据,一组是参考文献[2]给出的(见表7-8),这一组数据用图表示,见图7-4【18】。另一组数据是Duisman等测定的,见表7-9【19】。当m≈0.4时,
的值。下面列出两组有关数据,一组是参考文献[2]给出的(见表7-8),这一组数据用图表示,见图7-4【18】。另一组数据是Duisman等测定的,见表7-9【19】。当m≈0.4时,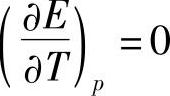 ;当m>0.4时,
;当m>0.4时,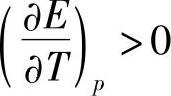 。
。
表7-8 铅酸蓄电池的电动势温度系数对于 H2SO4溶液质量摩尔浓度m的依赖关系(https://www.xing528.com)
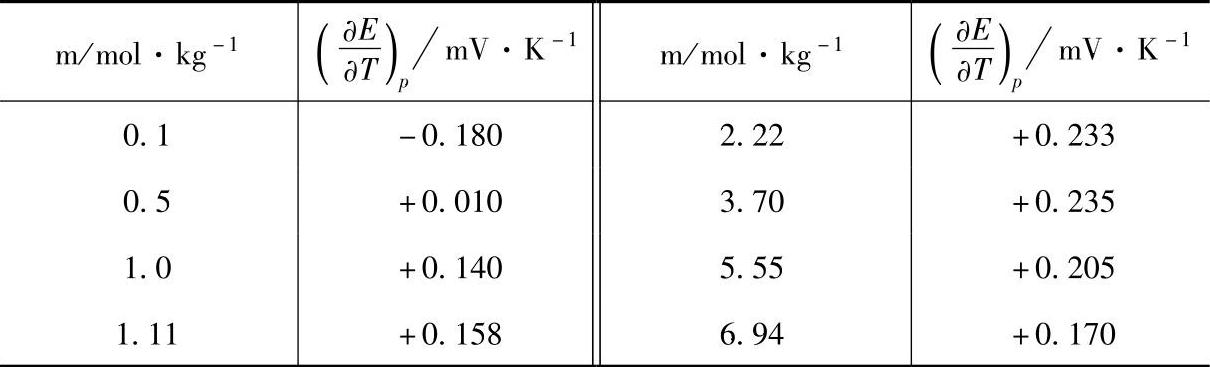
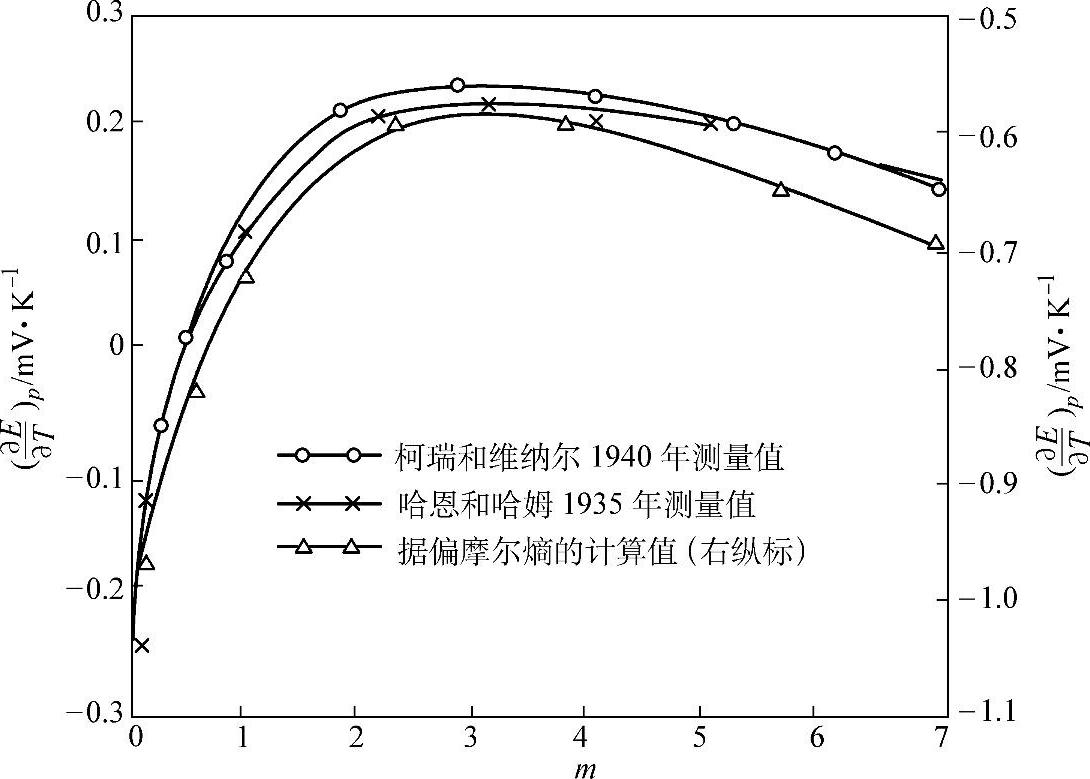
图7-4 铅酸蓄电池电动势的温度系数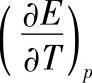 对于H2SO4溶液浓度m的依赖关系
对于H2SO4溶液浓度m的依赖关系
铅酸蓄电池实际使用的H2S04溶液,总是m>0.4,即总是有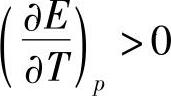 ,即电动势随着温度的升高而增高。在温度与25℃相差不太大的情况下,可以近似地用下式计算t℃时的电动势Et
,即电动势随着温度的升高而增高。在温度与25℃相差不太大的情况下,可以近似地用下式计算t℃时的电动势Et
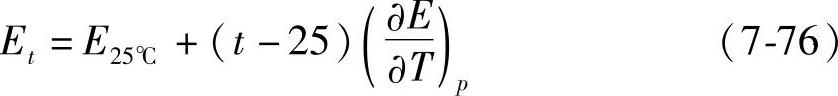
表7-9 铅酸蓄电池在298.15K时的电动势E298.15与给定温度下电动势Er之差
由式(7-75)可知
当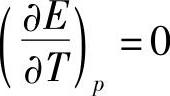 时,有nFE=-ΔH (7-77)
时,有nFE=-ΔH (7-77)
当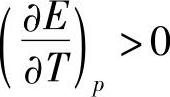 时,有nFE>-ΔH (7-78)式(7-78)说明,全部反应热转变为电能还不够,蓄电池本身还必须降温,把这部分热能也转变为电能。蓄电池在较小电流(如20h率或10h率)放电过程中温度下降是很常见的现象。但大电流放电时电阻热起了主导作用,蓄电池温度会上升。
时,有nFE>-ΔH (7-78)式(7-78)说明,全部反应热转变为电能还不够,蓄电池本身还必须降温,把这部分热能也转变为电能。蓄电池在较小电流(如20h率或10h率)放电过程中温度下降是很常见的现象。但大电流放电时电阻热起了主导作用,蓄电池温度会上升。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




