能斯特方程(Nernst equation)定量地描述了可逆电极的平衡电位与电极金属本性、溶液浓度(或活度)、温度之间的关系。
假定金属M与其离子Mn+的电极反应是
Mn++ne=M(7-47)
其平衡条件是

式中,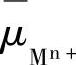 为溶液相中金属离子Mn+的电化学位;
为溶液相中金属离子Mn+的电化学位;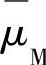 为金属相中金属M的电化学位;
为金属相中金属M的电化学位;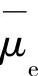 为金属中电子的电化学位;
为金属中电子的电化学位;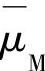 为金属
为金属
原子的化学位。
中性原子的电化学位(electrochemical potential)与其化学位(chemical potental)相等,故有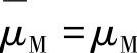 。根据电化学位的定义,有
。根据电化学位的定义,有
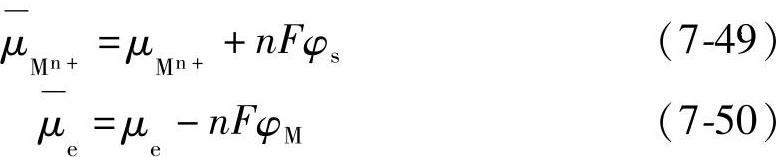
式中,φs为溶液的电位;φM为金属的电位;μ为电子的化学
e位;F为法拉第常数;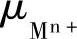 为金属离子Mn+的化学位。将式(7-45)和式(7-50)代入式(7-48)得到
为金属离子Mn+的化学位。将式(7-45)和式(7-50)代入式(7-48)得到
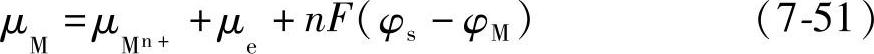
平衡时金属和溶液的电位差即平衡电极电位
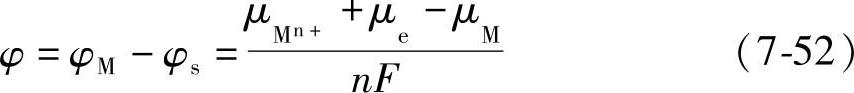
物质i的化学位μi与它的标准化学位μoi及其活度ai的关系在热力学上可以表示为
μi=μoi+RFlnai(7-53)纯金属相中的金属原子和电子的活度为1,因此得到
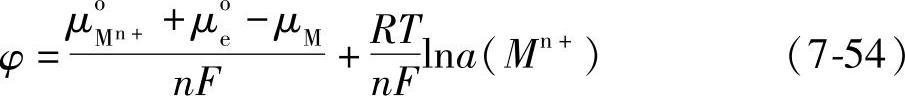
用φo表示式(7-54)中右边第一项,该式变为
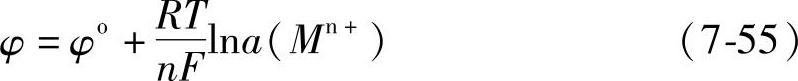
这是能斯特方程的一种形式。对下面的普遍的电极反应
uU+vV+ne=xX+yY (7-56)可以得到普遍的能斯特方程
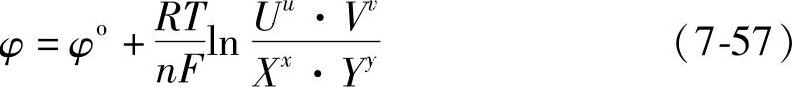
式中,右边最后一项分子中字母指氧化态物质,分母中字母指还原态物质。φo是做标准电极电位,指在101325Pa、25℃(标准状况)、氧化态与还原态的活度均为1单位时的平衡电极电位。式(7-53)~(7-57)中R是气体常数。R=8.314J·mol-1·K-1,T是热力学温度(K)。
现在应用能斯特方程来计算铅酸蓄电池两极的平衡电极电位。如式(7-2)所示,负极的电极反应是
Pb+HSO4--2e=PbSO4+H+应用式(7-57)得到正负的平衡电极电位φ-
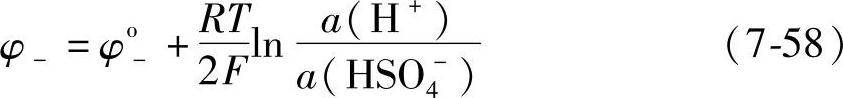
显然,式中φo-是负极标准电极电位。正极的电极反应是式(7-1):
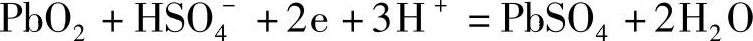
应用式(7-57)得到正极的平衡电极电位φ+
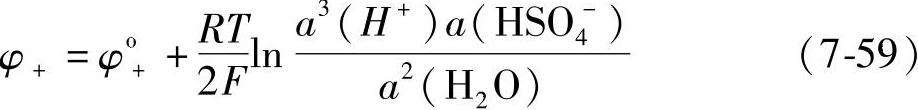
式中,φo+是正极标准电极电位。式(7-58)和式(7-59)中的a(H+)、a(HSO-4)和a(H2O)分别表示H+、HSO-4和H2O的活度。φ+与φ-之差就是蓄电池的电动势(https://www.xing528.com)
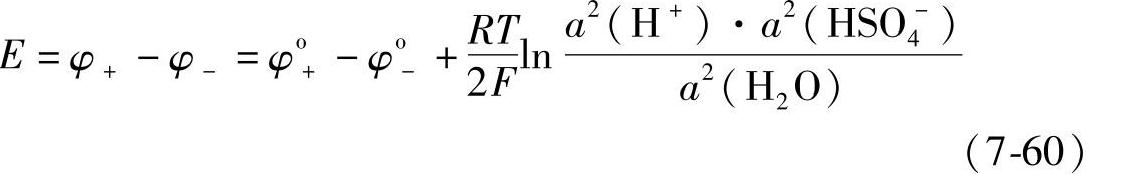
由式(7-22)可知
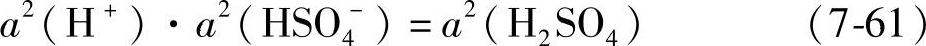
并且令 Eo=φo+-φo- (7-62)
那么式(7-60)可以写成
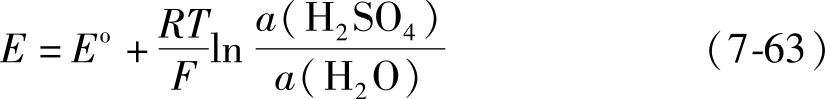
计算电动势E,需求出标准状态(101.325kPa,a(H2SO4)=a(H2O))下的电动势,即标准电动势Eo的值。Eo是正极与负极标准电极电位之差。Eo也可以由公式

计算。这里ΔGo是电池反应产物与反应物标准生成自由能之差。早期曾把H2SO4视为2-1型电解质参与电池反应:
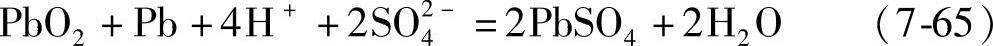
实际上,H2SO4的二级离解常数较小,可把它视为1-1型电解质参与反应:
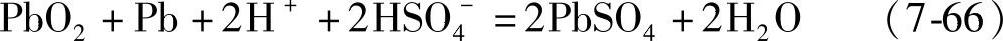
根据式(7-65)或式(7-66)计算出来的Eo值是不同的。
式(7-63)即能斯特方程中还含有H2SO4的活度a(H2SO4)和水的活度a(H2O)。其中a(H2SO4)还涉及H2SO4溶液中离子的平均活度系数。独立测定活度与活度系数的方法有蒸气压法、凝固点法和电动势法。例如测定电池的电动势,就可以计算出H2SO4溶液的活度系数【6,7】。用蒸气压法测量的有关文献也不少【8,9】。
美国国家标准局(United States National Bureau of Standard)的Staples汇集了关于电动势法、蒸气压法和凝固点法测量活度的文献,并提出25℃时,浓度0.001~27.5m的H2SO4溶液中H2SO4的活度系数与水的活度的推荐值。他认为电动势法测得的值最为前后一致【10】。
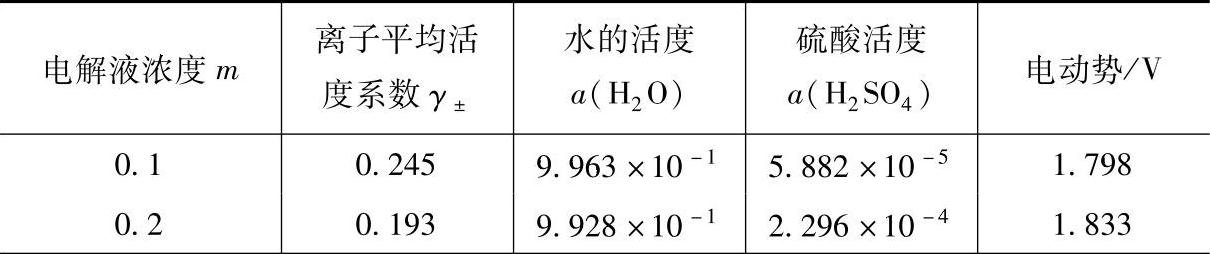
表(7-6)中列出25℃时H2SO4的活度系数γ±。这是Coving- ton提出来的【11】,依据的是电池
(Pt)H2H2SO4(m)PbSO4 β—PbO2(Pt)(7-68)和(Pt)H2H2SO4(m)Hg2SO4(Hg)(7-69)这两种电池的电动势数据。根据这两种电池电动势测量的活度系数值很好地符合一致。关于电池电动势,有不少著作有深入论述【12,13】。
表(7-6)中水的活度a(H2O)引用的是Robinson等的数据【14】,而硫酸的活度a(H2SO4)与电动势是计算值。计算中采用的标准电极电位值分别为式(7-68)所表示的电池的标准电位1.690V和电池
Pb(Hg)PbSO4H2SO4(m)H2(Pt)(7-70)的标准电位值。25℃时,铅酸蓄电池的标准电动势正是这三个标准电极电位之和,取2.048V是个较好的值。
表7-6 铅酸蓄电池的热力学数据
(续)
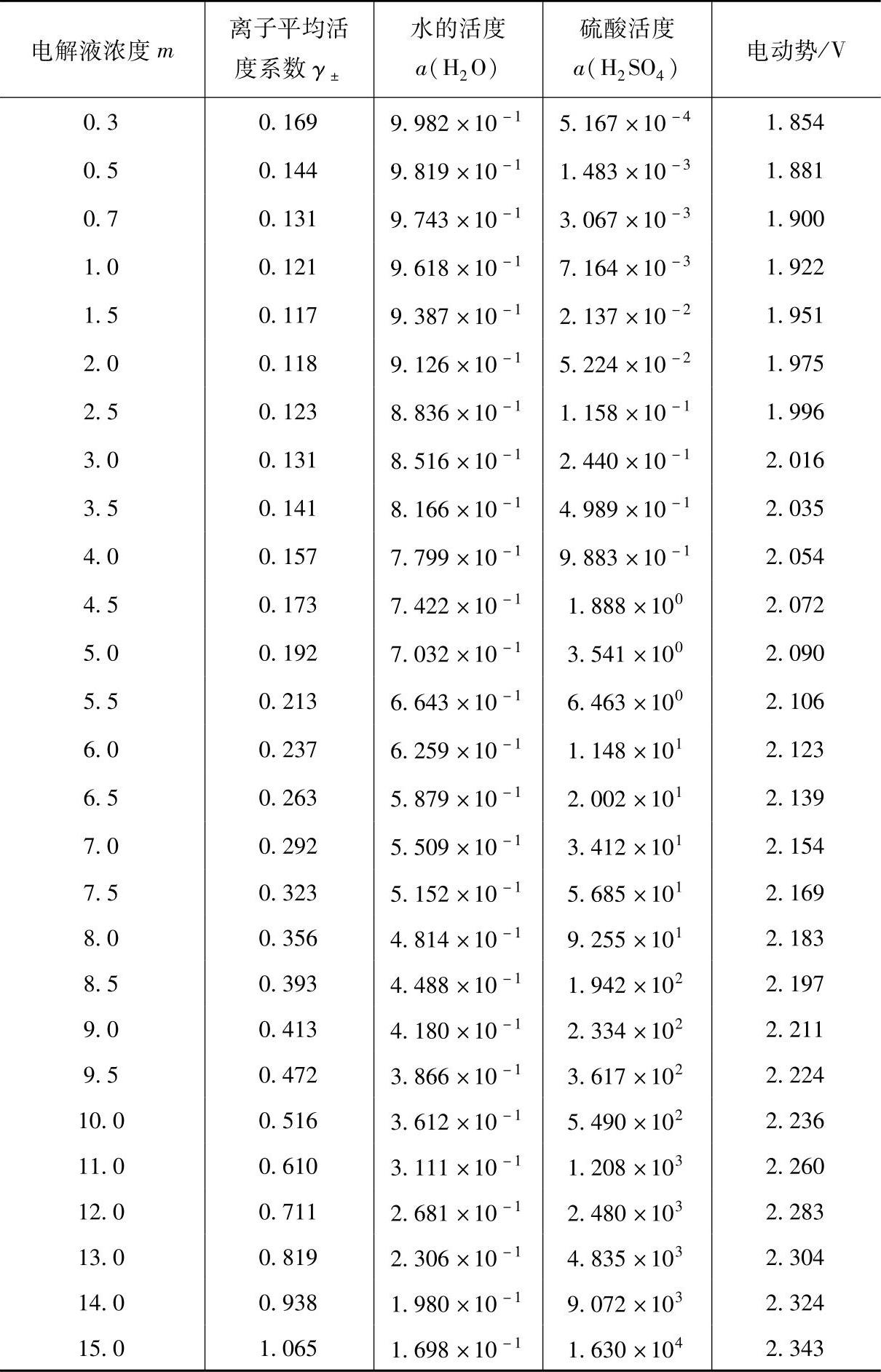
表7-6中所列的电动势的值与国际纯粹化学和应用化学联合会(IUPAC)1985年公布的标准电极电位研究中心铅酸蓄电池的电动势的值以及早期有关文献的值是一致的【15,16】。
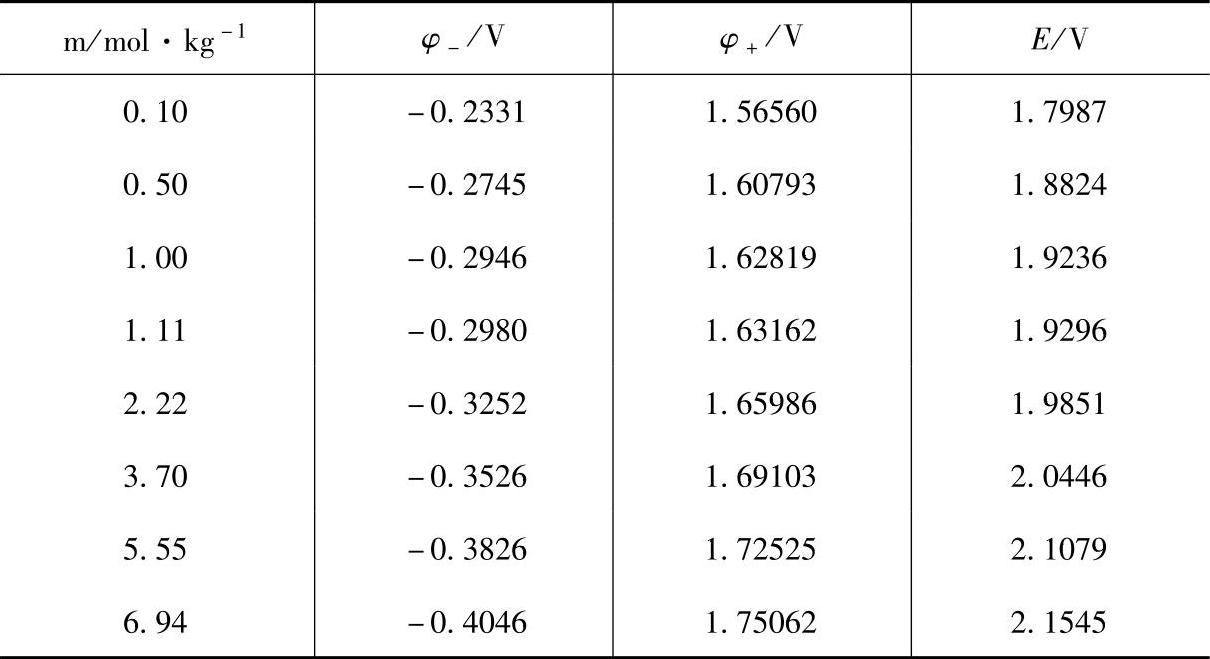
表7-7是参考文献[2]给出的数据,读者可进行比较【17】。
同样都是实验值,测量得到的蓄电池电动势的值也不尽相同。早期蓄电池板栅合金的含锑量较高,自放电反应速率快,会引起电极内部的电解液浓度降低,导致电动势的测定值较低。还有,涂膏式极板的正极活性物质中一般都含有不同含量的α-PbO2,随着蓄电池循环次数增加,α-PbO2含量会逐渐减少。α-PbO2在硫酸溶液中的标准电极电位比β-PbO2约高8mV。这也会引起蓄电池电动势实验值的差异。另外,如果正极活性物质中因化成不足含有PbO,或者因过充电而含有其它化合物如过硫酸盐,都能影响电动势的实验值。
表7-7 25℃时铅酸蓄电池的负极平衡电极电位φ-、正极平衡电极电位φ+和电动势E对H2SO4溶液浓度m(质量摩尔浓度)的依赖关系
实验值与计算值之间也会有差异。例如正极的平衡电极电位φ0+所指的参与电极反应的铅的氧化物的化学组成恰好与PbO2的化学式相符,而实际上电极上物质的组成与PbO2有显著差别,而且因制造方法、温度和接触的溶液而不同,其化学式接近PbO1.96。更何况PbO2还有两种不同的晶体α-PbO2与β-PbO2呢。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




