我们知道,金属和它的盐溶液界面之间达到平衡时的电位差就叫金属的平衡电极电位(equilibrium potential)。这种电位差是如何产生的呢?
电极一般都是由金属构成的。金属的晶体结构是由整齐排列成晶体的金属离子和在其间流动着的电子组成的。例如,当一片金属铜插在CuSO4水溶液(a=1)中时,形成一个可逆的铜电极Cu‖CuSO4(a=1,水溶液)(见图7-2)【5】。
铜(固相)中的电子e和溶液(液相)中的离子HSO4-和H2O都不能迁越相界面,Cu2+离子是唯一可以迁越相界面的物质。在固/液相界面上有可能发生下面的迁越反应:
Cu2+(固相)→Cu2+(液相) (7-32)
即Cu(固相)-2e(固相)→Cu2+(液相) (7-33)
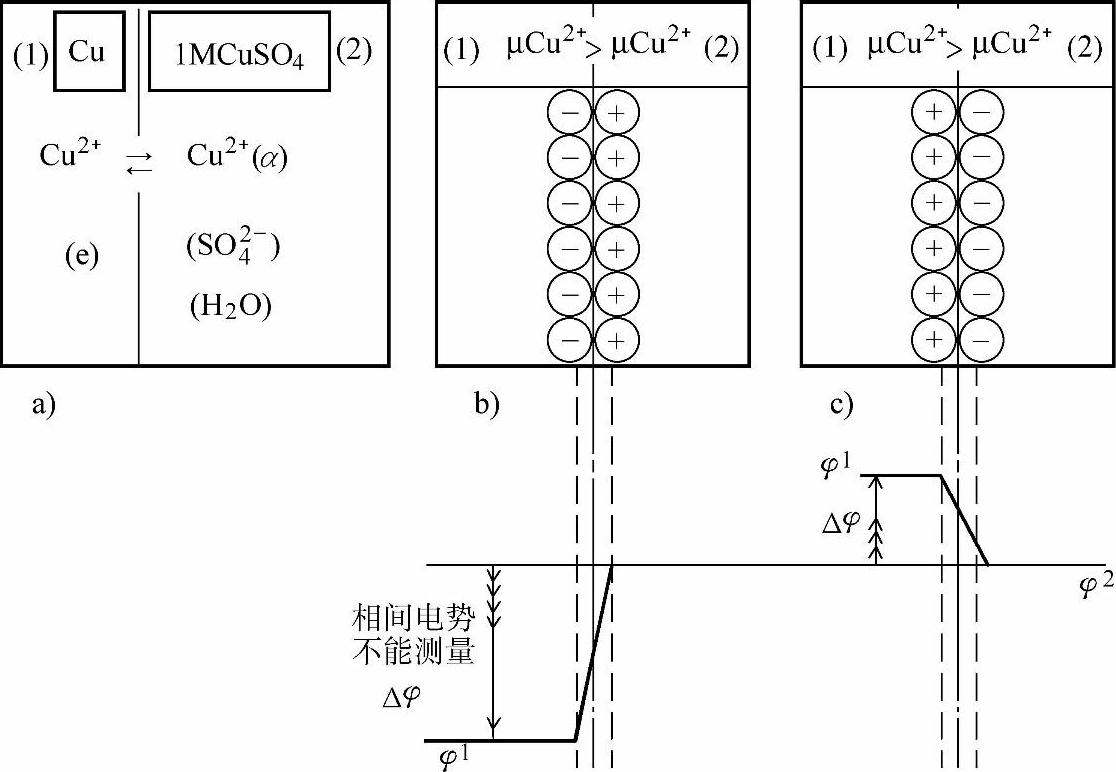
图7-2 双电层和平衡电极电位
a)可逆的铜电极 b)铜离子进入溶液形成双电层 c)铜离子留在金属上形成双电层
用 和
和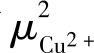 分别表示在Cu2+在固相和液相中的化学位。假设
分别表示在Cu2+在固相和液相中的化学位。假设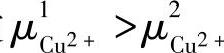 ,则反应式(7-32)的正向反应倾向占优势,结果是Cu2+进入溶液,把电子留在固相金属上。由于固相和液相都是导体,故固相留下的电子和液相的Cu2+将相互吸引,使它们分别聚积在两相界面附近处而形成电化学双电层(electrochemical double layer)。这样就建立起固/液相之间的电位差Δφ,即
,则反应式(7-32)的正向反应倾向占优势,结果是Cu2+进入溶液,把电子留在固相金属上。由于固相和液相都是导体,故固相留下的电子和液相的Cu2+将相互吸引,使它们分别聚积在两相界面附近处而形成电化学双电层(electrochemical double layer)。这样就建立起固/液相之间的电位差Δφ,即
Δφ=φ1-φ2(7-34)
式中,φ1和φ2分别表示固相和液相的电位。这时Δφ应有负值。建立起来的负电位差抑制式(7-32)的正向反应,同时增强了逆向反应。最后,电极上的电位达到某一数值,正向和逆向反应速率相等,建立起Cu2+的相界的平衡,此时的电极电位就是平衡电极电位。
相反,如果 ,即反应式(7-32)的逆向反应倾向占优势,结果是液相中一些Cu2+离子迁越到固相上,溶液中有过剩的HSO4-形成双电层。最后形成的平衡电极电位和固相上留有电子的情况符号相反。
,即反应式(7-32)的逆向反应倾向占优势,结果是液相中一些Cu2+离子迁越到固相上,溶液中有过剩的HSO4-形成双电层。最后形成的平衡电极电位和固相上留有电子的情况符号相反。
达到相界平衡时电极上的电荷的符号和密度依赖于金属的种类,溶液中该离子的浓度、温度以及溶液的pH值。正是电极上的电荷的符号和密度决定了它和溶液(固相—液相界面)的电位差的符号和大小。当然,在有气体参加的电极反应的情况下,气体的压强要影响电极电位。
我们来看看两支不同的金属电极浸在相互沟通的溶液中而形成原电池的情况。最常见的例子是由浸在ZnSO4溶液中的锌电极和浸在CuSO4溶液中的铜电极构成的丹尼尔电池(Daniel cell),是早年由英国化学家J.F Daniel(1790—1845)提出的(见图7-3)。
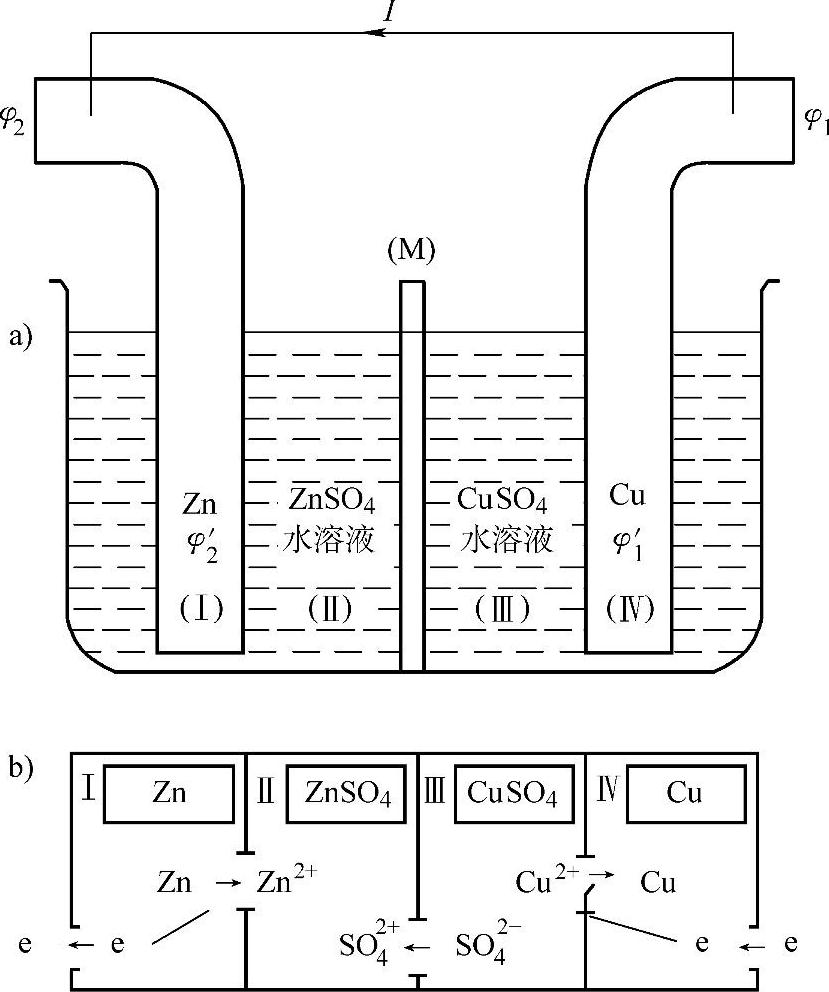
图7-3 丹尼尔电池示意图
a)Cu、Zn、水溶液和半透膜(M)组成的丹尼尔电池 b)丹尼尔电池内部电子和负离子的流动方向
在外电路接通后,外电路从Cu到Zn电极有电流I流过。那么在溶液内部,电流的方向则是从Zn流向Cu电极。设外电路电阻为R,溶液中的电阻称为内阻r,外电路中Cu和Zn电极的电位分别为φ1和φ2,溶液内部Cu和Zn电极与溶液界面处的电位分别为φ1′和φ2′。按照欧姆定律,在外电路 φ1-φ2=IR (7-35)在溶液内部 φ1′-φ2′=Ir (7-36)上述两式之和为(https://www.xing528.com)
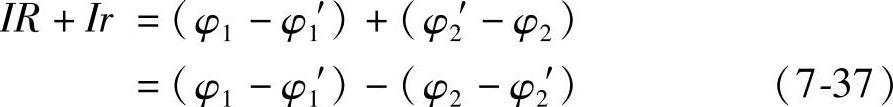
根据我们的定义,金属和它的溶液界面之间的电位差就叫金属的电极电位。这里我们就用φCu/Cu2+和φZn/Zn2+表示Cu和Zn电极的电极电位。那么就有

式(7-37)就可以写成
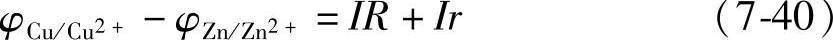
引入电动势(electromotive force:e.m.f.)E(电池中正极与负极电极电位之差),式(7-40)写成
E=IR+Ir (7-41)如果把外电路中的电位降落φ1-φ2=IR用端电压U来表示,式(7-41)就是
E=U+Ir或U=E-Ir (7-42)
式(7-41)和(7-42)就是关于闭合电路的欧姆定律,又称全电路欧姆定律。
蓄电池在充电时,电流方向和前述情况相反,闭合电路欧姆定律的表达式是
E=U-Ir或U=E+Ir (7-43)
即蓄电池在放电时,蓄电池两极的端电压U等于它的电动势减去内部电位降Ir;充电时端电压U等于电动势加上内部电位降Ir。
在前述原电池的情况下,外电路的电流方向是从Cu到Zn电极,即从高电位流向低电位,在电极与溶液的界面却是从低电位流向高电位,即流过一个电位跃变。这一现象不可能用物理学的静电力来解释。这种非静电力的产生是由于电极与溶液界面的电化学反应:
在正极 Cu2++2e=Cu (7-44)
在负极 Zn-2e=Zn2+ (7-45)
电池反应 Cu2++Zn=Cu+Zn2+ (7-46)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




