先就一般意义谈谈电解质的活度(activity)。非电解质溶液特别是接近理想溶液(ideal solution;perfect solution)的稀溶液,其平衡性质有“依数性”(colligative property),如溶剂的蒸气压降低、沸点升高、凝固点下降和渗透压等性质。电解质溶液的平衡性质偏离了理想溶液。活度可以认为是有效浓度[3]。活度a与浓度C的关系为
a=γC(7-11)γ称为活度系数(activity coefficient)。
假设某电解质Mv+Mv-在溶液中按下式离解:
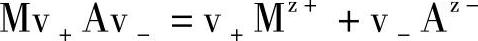
在理想溶液中,离子的化学位(chemical potential)μ+、μ-与正负离子浓度C+、C-的关系为
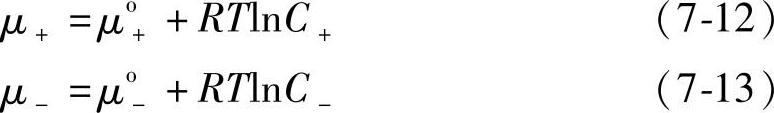
式中,R是气体常数;T是热力学温度,μo+、μo-分别是正、负离子的标准化学位,即单位浓度时的化学位。如果不是理想溶液,就要用活度a代替浓度C。

电解质的化学位μ2应为正、负离子的化学位之和
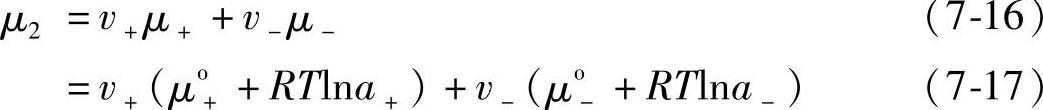
电解质的化学位还应服从下式:
μ2=μ2o+RTlna2 (7-18)
式中,μ2o是电解质的标准化学位,即其活度为1时的化学位;a2是电解质的活度,注意到式(7-17)和式(7-18)相等,得到
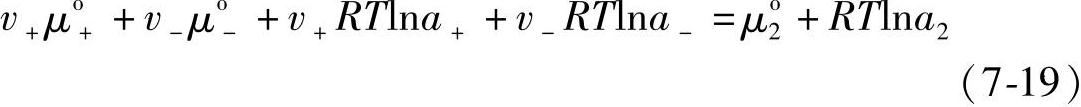
显然, μ2o=v+μo++v-μo- (7-20)
那么就有 v+RTlna++v-RTlna-=RTlna2 (7-21)
得到 a2=av++·av-- (7-22)
令v=v++v-。用a±表示离子的平均活度,其定义是
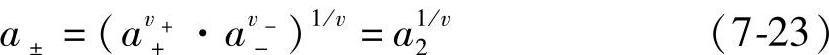 (https://www.xing528.com)
(https://www.xing528.com)
离子的活度a+、a-与其浓度C+、C-之比称为离子的活度系数γ+、γ-

电解质的平均活度系数γ±定义为

引入式(7-24)和式(7-25)得到
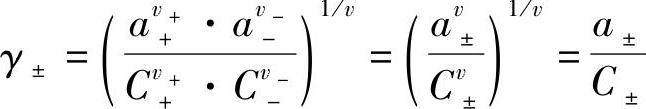
即
式中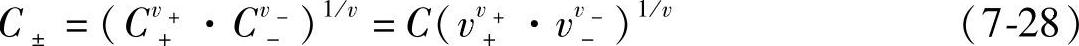 C±是电解质的平均浓度,和溶液浓度C有关,把式(7-27)、式(7-28)引入式(7-22)得到
C±是电解质的平均浓度,和溶液浓度C有关,把式(7-27)、式(7-28)引入式(7-22)得到
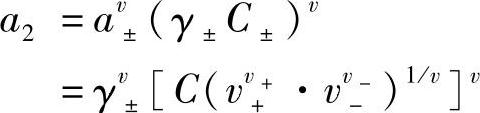
即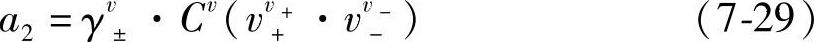
H2SO4在水溶液中作为2-1型的三元电解质,v+=2,v-=1,v=3,应用式(7-29)得到

H2O—H2SO4体系中水的活度a(H2O)指的是一定温度下与溶液达成平衡的气相中水的蒸汽压强(P0)与同温度下纯水的蒸汽压强(P)之比,即

在25℃,水的蒸汽压强P0=3.138kPa。
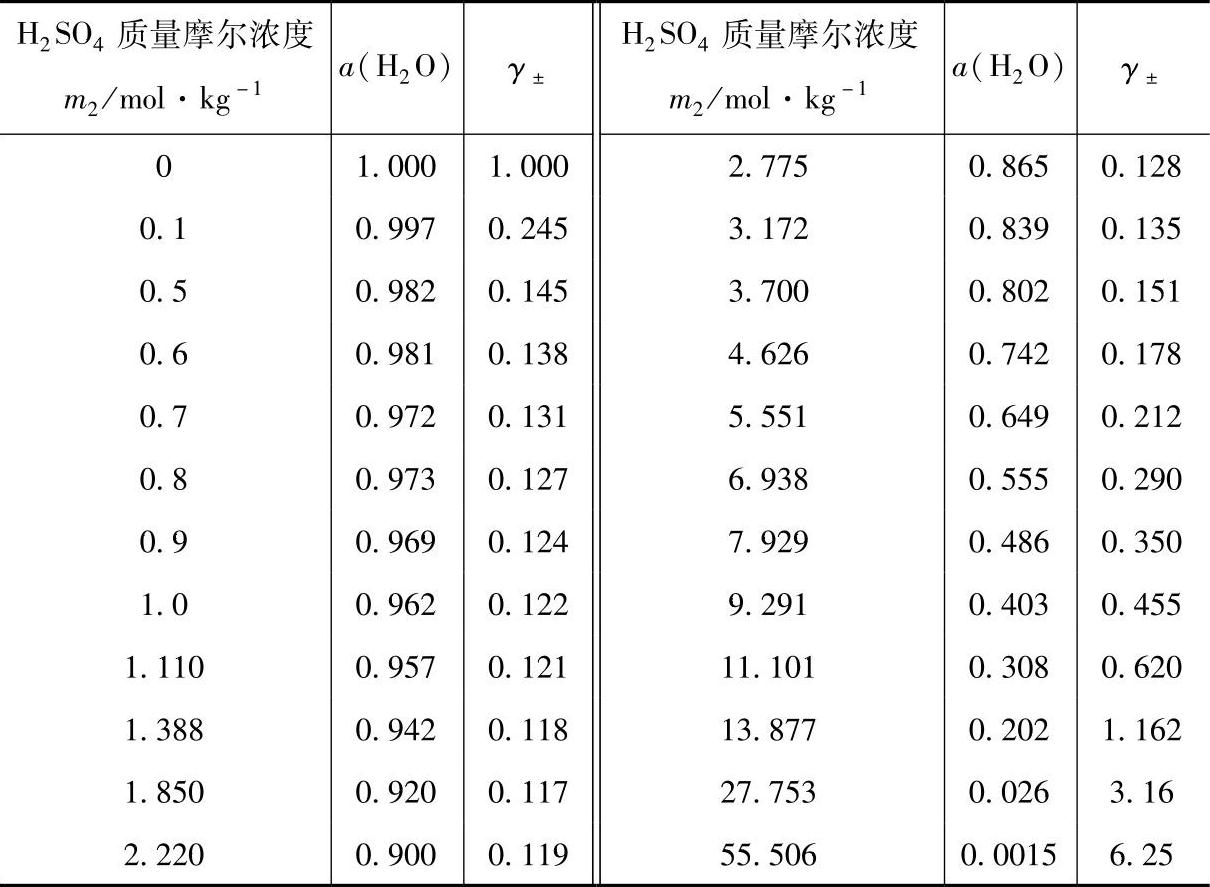
H2O—H2SO4体系中H2SO4的平均活度系数的电化学方法测定值和水的活度的测定值见表7-5【4】。
表7-5 H2O—H2SO4体系中水的活度a和H2SO4的平均活度系数γ±(25℃)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




