恒定电流流过一段时间通过的电量是电流强度与时间的乘积。都采用国际制单位基本单位,电流为安培(A),时间为秒(s),电量为库仑(C)。
1C=1A·s
铅酸蓄电池实际应用的电量(容量)单位是安培·小时(A·h)。安培·小时与库仑的关系是
1A·h=1A×3600s=3600C1法拉第(F)电量是9.64846×104C,即

近似地,1F=26.80A·h。
英国物理学家和化学家法拉第(Michael Faraday)于1833年总结出两条定律,用以表示电极上通过的电量与电极反应产物数量之间的关系:
(1)电流通过溶液时,在电极上发生变化的物质的量与所通过的电量成正比;
(2)当相同的电量通过各种不同的电解质溶液时,在各个电极上发生变化的物质的量与它们的化学当量成正比。
当量(equivalent)是表示元素与化合物相互化合时的质量比的数值,以12C为3.000、氧为8.000、氢为1.008作基准,求得其它纯物质相互化合时的相对质量,也称化合量。
实验表明,在电极上电解析出1当量物质,需要1F电量。一种元素或化合物的当量有时可以有几个不同的值。例如高锰酸钾KMnO4在不同酸度的介质中发生还原反应时,可以生成二氧化锰MnO2、三氧化二锰Mn2O3或Mn2+,其当量就分别是KMnO4摩尔质量的1/3、1/4或1/5。根据国际SI制的规定,当量概念将不再在化学中使用,我国法定计量单位也做了类似的规定。对于铅酸蓄电池的电化学反应,法拉第定律可以叙述为:
当1F电量通过电极时,在电极上生成(或消耗)1mol物质。
这里的1mol,对于二氧化铅是指1/2 PbO2,对于金属铅是指1/2 Pb,对于硫酸是指1/2 H2SO4。这只要看看正、负极的电极反应式中转移的电子的量是2mol就明白了。
正极反应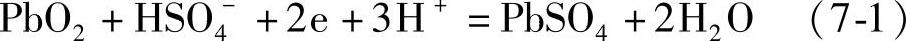
负极反应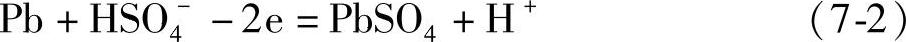 (https://www.xing528.com)
(https://www.xing528.com)
电池反应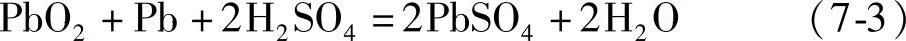
对于蓄电池充电时发生的副反应
正极反应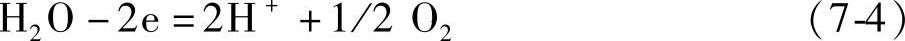
负极反应 2H++2e=H2 (7-5)
电池反应 H2O=H2+1/2 O2 (7-6)
1mol对于氧是指1/2 O,对于氢是指1/2 H2。
蓄电池充电时在正极既有二氧化铅,也有氧同时生成;在负极既有金属铅,也有氢同时生成。这种情况下1F电量生成的物质,正极上是指两种物质的摩尔数之和为1mol;负极上也是两种物质的摩尔数之和为1mol。
据此,铅酸蓄电池放出1F(26.80A·h)电量,消耗的物质为
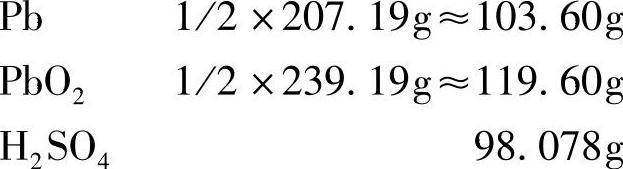
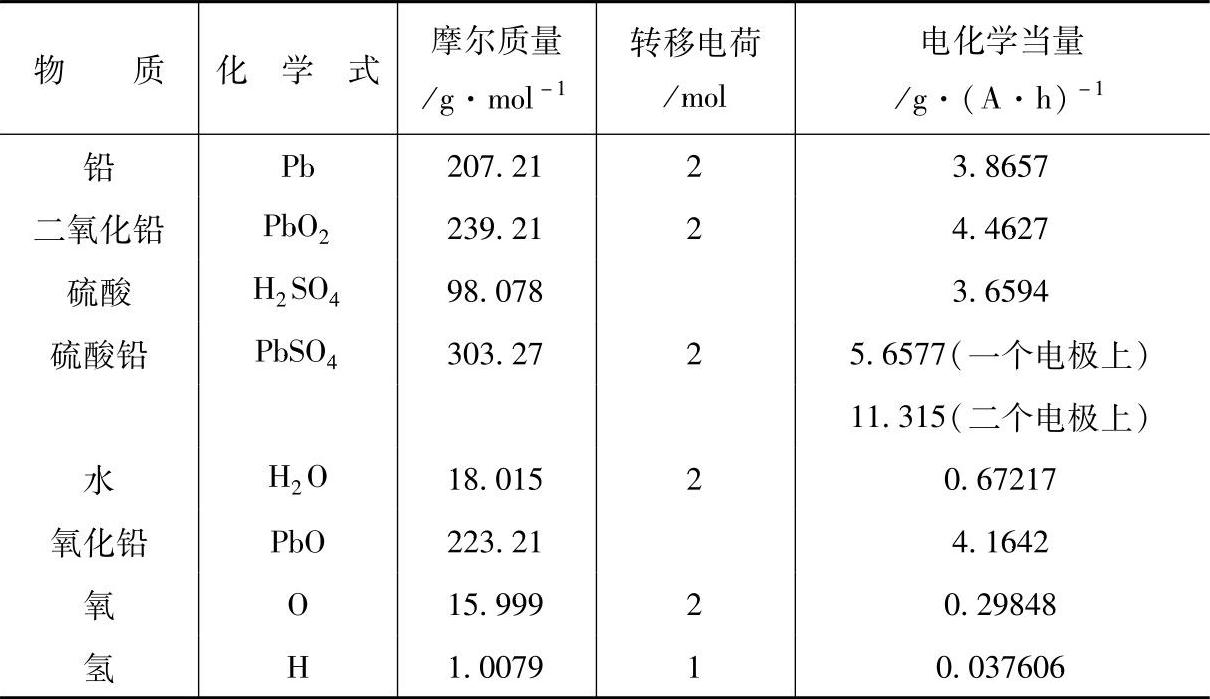
虽然当量一词在当今的化学书籍中已不引用,但蓄电池界还在习惯上运用电化学当量(electrochemical equivalent)的概念。电化学当量是指在一个电极反应中,相当于转移1mol电子的参与电极反应的物质的量。对于电极上氧化数发生变化的物质(如PbO2中的铅变为PbSO4的铅,氧化数由4变为2),电化学当量即其摩尔质量与氧化数前后(或后与前)之差的比值。表7-1列出铅酸蓄电池充放电时电极反应及副反应中有关物质的电化学当量。
表7-1 铅酸蓄电池有关物质的电化学当量
法拉第定律适用于任何温度、压力、水溶液、非水溶液、熔融盐等物系,是电化学中最重要的定律之一,更是铅酸蓄电池电量(容量)的理论依据。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




