目前我国生产的起动用铅酸蓄电池还有一大部分不是阀控密封式的,而只是少维护的。这种蓄电池的板栅多采用低锑铅基合金,虽然在运行中失水速率已有很大减缓,但在使用中还需要加水,尤其是在夏季。汽车中蓄电池的安放位置一般距离发动机不远,夏季运行中温度不低,失水较快,补水在所难免。
当今城镇中的汽车配件和铅酸蓄电池销售部门很多,其中多数备有铅酸蓄电池电解液。通常有两种溶液:“原液”和“补液”。所谓“原液”即密度为1.28kg·L-1的H2SO4溶液,用来灌注干式荷电铅酸蓄电池。所谓“补液”也是H2SO4溶液,但密度无统一要求,一些专业配制的厂家的产品多为密度1.1kg·L-1。
运行中的铅酸蓄电池因失水而经常注入“补液”是一个误区。一些用户看到铅酸蓄电池液面有所下降就注入“补液”以弥补失水,导致电解液浓度不断增大,H2SO4浓度大即氢离子浓度大,析气失水会更快,注液就更频繁,H2SO4浓度就进一步增大……形成一个恶性循环,导致铅酸蓄电池腐蚀加速,容量下降,硫酸盐化加剧并提前失效。
1.运行中失水的起动用铅酸蓄电池应当补水
早期的铅酸蓄电池装配不紧凑,电解液的量较大,要求的电解液密度较低,一般热带为1.225kg·L-1,温带为1.265kg·L-1。后来普遍采用1.280kg·L-1的H2SO4溶液作为电解液,无论从离子迁移(ion mobilities)、电导、电动势以及板栅、极板的腐蚀诸方面衡量,这一数值都是适宜的。许多著作对此认可并强调,除非是蓄电池倾翻,酸液外溢,一般情况下切勿加酸[12]。我国出版的有关铅酸蓄电池的教材和著作也指出应当补水而不应补酸[13]。作者还进一步指出,电解液液面低的原因不明,应先加水,然后进行充电。
事实上,汽车在运行时,蓄电池处于充电状态,正、负极的电化学反应和电池反应分别是
正极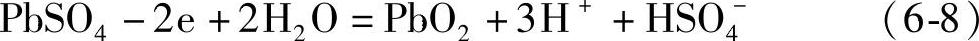
和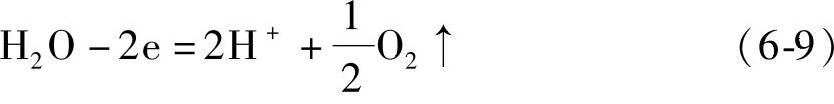 (https://www.xing528.com)
(https://www.xing528.com)
负极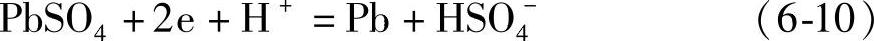
和 只是简单地从化学平衡的角度就可以看出,H2SO4浓度大即氢离子浓度大不利于充电反应[见式(6-8)]的进行,而有利于析出氢的反应[见式(6-11)]的进行。H2SO4溶液浓度高会加快气体析出和板栅的化学与电化学腐蚀。调整蓄电池液面高度注入所谓“补液”势必增大电解液浓度。蓄电池在运行中失去的绝大部分是水,气体逸出带出的H2SO4是很少的,无需为此补充H2SO4溶液。
只是简单地从化学平衡的角度就可以看出,H2SO4浓度大即氢离子浓度大不利于充电反应[见式(6-8)]的进行,而有利于析出氢的反应[见式(6-11)]的进行。H2SO4溶液浓度高会加快气体析出和板栅的化学与电化学腐蚀。调整蓄电池液面高度注入所谓“补液”势必增大电解液浓度。蓄电池在运行中失去的绝大部分是水,气体逸出带出的H2SO4是很少的,无需为此补充H2SO4溶液。
给荷电不足的蓄电池注入H2SO4溶液是出于一种误解,似乎这么做蓄电池荷电会充足些。实际上这并不能改善极板的荷电状态。只有充电才能增加正极板上的PbO2和负极板上的海绵状金属铅。注入H2SO4溶液并不能使PbSO4转化成PbO2和Pb。有作者指出,在放电状态的蓄电池中注入H2SO4溶液并不能使蓄电池产生电能,并列出数据说明硫酸溶液密度的增大会缩短蓄电池寿命(见表6-7)[14]。
表6-7 起动用铅酸蓄电池电解液密度与使用循环寿命的关系
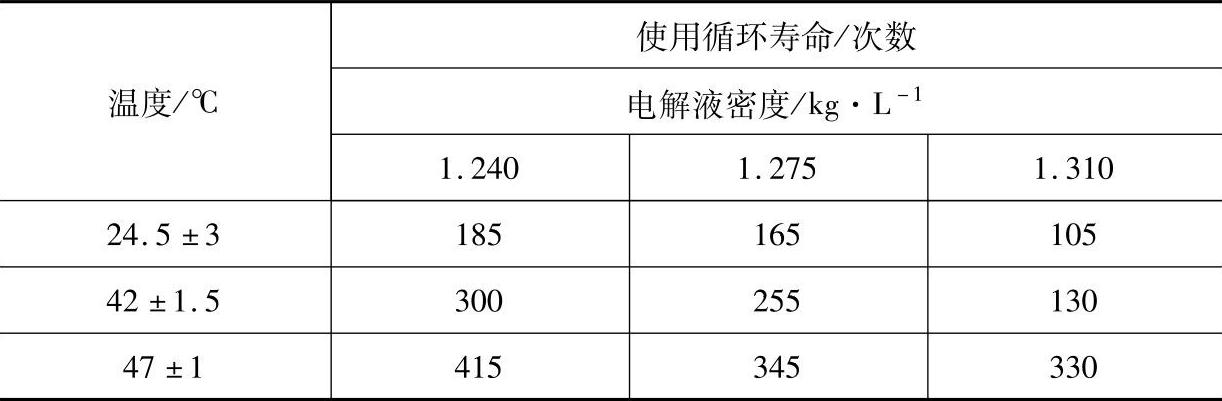
关于表6-6中得到的数据的具体实验条件作者有所叙述,这里不赘。但可以肯定的是,H2SO4溶液浓度大,不利于寿命。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




